题目内容
【题目】(12分)某学习小组围绕“气体实验室制取”进行了研讨。请你参与完成下面的问题。

(1)原理分析:实验室制取CO2的化学方程式为 _____________________________。
不用Na2CO3与盐酸反应制取CO2的原因是_____________________________。
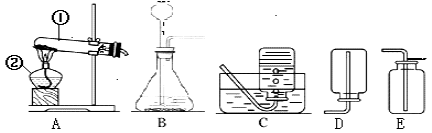
(2)发生装置:图①装置中仪器a的名称是____________________。实验室常用无水醋酸钠固体与碱石灰在加热的情况下制CH4,应选图_______________(填序号)发生装置。
(3)收集装置:实验室收集NH3(极易溶于水)应采用的方法是____________________。收集有毒气体SO2时,常采用③收集装置,气体应从_____________(填字母)端通入。
【答案】(1)CaCO3+2HCl═CaCl2+H2O+CO2↑;反应速率太快;(2)锥形瓶;②;(3)向下排空气法;c.
【解析】
试题分析:(1)实验室制取CO2的药品是碳酸钙和稀盐酸,化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
不用Na2CO3与盐酸反应制取CO2的原因是:碳酸钠易溶于水,能和稀盐酸充分接触,会导致反应速率过快,气体不易收集;
(2)图①装置中仪器a的名称是锥形瓶,常用作反应容器;
实验室常用无水醋酸钠固体与碱石灰在加热的情况下制CH4,应选图②发生装置.
(3)氨气的密度比空气小,极易溶于水,因此只能用向下排空气法收集;收集有毒气体SO2时,常采用③收集装置,气体应从长管c进入,因为二氧化硫的密度比空气的密度大;

【题目】(17分)实验室常用石灰石和稀盐酸制取二氧化碳。
探究一 气体发生装置的选择
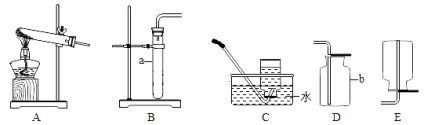
(1)写出图中带标号仪器的名称:a ;b 。
(2)实验室制取二氧化碳气体,发生和收集装置分别选用 和 (填字母),
检验集满的方法是 。
探究二 药品的选择
小明对三组药品进行了研究,实验记录如下:
组别 | 药 品 | 实验现象 |
① | 块状石灰石和稀盐酸 | 产生气泡速率适中 |
② | 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
③ | 粉末状石灰石和稀盐酸 | 产生气泡速率很快 |
对照实验①③,是探究 对产生二氧化碳速率的影响;
对照实验 ,是探究不同的酸对产生二氧化碳速率的影响;
小明选择第①组药品来制取二氧化碳,该组反应的化学方程式为;
探究三 生成二氧化碳量的测定
实验室常通过下列两种途径测量生成二氧化碳的量
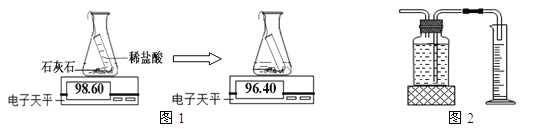
途径一(如图1):由图可知产生二氧化碳的质量为 g。
途径二(如图2):通过排水法测得生成二氧化碳的体积。
由上两种途径比较,你认为哪种途径实验结果更为准确,理由是 。