题目内容
【题目】如图是初中化学一些重要实验,请回答下列问题:
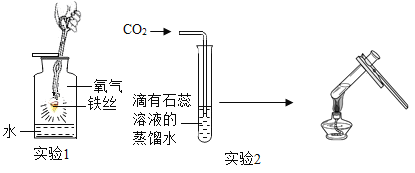
(1)实验1的现象:剧烈燃烧,___________________,放热,生成黑色固体。
(2)实验1中反应的化学方程式是____________________________。
(3)实验1集气瓶底部放入少量水的目的是__________________________。
(4)实验2石蕊溶液变红的原因是_________________________(用化学方程式表示)。
(5)实验2加热液体时可观察到的现象是__________________________。
【答案】火星四射  防止生成的高温熔化物溅落下来炸裂瓶底
防止生成的高温熔化物溅落下来炸裂瓶底 ![]() 有气泡,溶液由红色变紫色
有气泡,溶液由红色变紫色
【解析】
(1)实验1是铁丝在氧气中燃烧,现象是:刷烈燃烧,火星四射、放热,生成黑色固体。
(2)实验1是铁丝在氧气中燃烧生成了四氧化三铁,反应的化学方程式是:3Fe+2O2![]() Fe3O4。
Fe3O4。
(3)实验1铁丝在氧气中燃烧,集气瓶底部放入少量水的目的是:防止生成的高温熔化物溅落下来炸裂瓶底。
(4)实验2石蕊溶液变红的原因是二氧化碳与水化合生成了碳酸,碳酸显酸性,方程式是:H2O+CO2═H2CO3。
(5)实验2加热液体时碳酸易分解生成了二氧化碳和水,可观察到的现象是:有气泡,溶液由红色变紫色。
故答为:(1)火星四射;(2)3Fe+2O2![]() Fe3O4;(3)防止生成的高温熔化物溅落下来炸裂瓶底。(4)H2O+CO2═H2CO3;(5)有气泡,溶液由红色变紫色。
Fe3O4;(3)防止生成的高温熔化物溅落下来炸裂瓶底。(4)H2O+CO2═H2CO3;(5)有气泡,溶液由红色变紫色。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
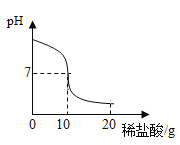
全优冲刺100分系列答案【题目】将20.0g稀盐酸逐滴加入到10.0g溶质质量分数为40%的氢氧化钠溶液中,边滴加边搅拌,随着稀盐酸的滴加,溶液的pH变化情况如图所示,溶液的温度变化如表所示(不考虑反应过程中热量散失)
反应时间(s) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
溶液温度(℃) | 20.5 | 20.6 | 20.7 | 20.8 | 20.9 | 20.8 | 20.7 |
(1)当稀盐酸与氢氧化钠溶液恰好完全反应时,溶液的温度是_____℃
(2)计算稀盐酸中溶质的质量分数_________(精确到0.1%)
【题目】某化学小组的同学在老师的指导下,设计如下装置验证碳酸钙的性质的同时,探究氧化钙与二氧化碳在加热的条件下是否也能发生反应生成碳酸钙。

(1)C中的反应方程式为_____。
(2)实验后小组同学对E中固体的成分进行探究。
[猜想与假设]E中的固体可能为a氧化钙; b氧化钙与碳酸钙; C 碳酸钙
[进行实验]
实验步骤 | 现象 | 结论或化学方程式 |
①取一定量的E中固体于试管中,并加入一定量的水,振荡。 | 有白色不溶物 | 能否证明猜想c成立_____(填能、否),理由是_____。 |
②取一定量的E中固体于试管中,并加入一定量的水并滴加_____试液。 | 试管中液体显红色 | 试管中反应的化学方程式_____。 |
③再在上述试管中滴加足量的稀盐酸。 | 试液中有气泡产生 | 证明所取一定量E中固体的成分是_____(填化学式)。 |
(3)煅烧含碳酸钙50克的石灰石,完全分解则产生氧化钙的物质的量是多少? _____(根据化学方程式列式计算)
【题目】某校兴趣小组在实验室中完成制取氧气的实验。他们取氯酸钾和二氧化锰的混合物共6g放入大试管中加热,并在同时测定试管中剩余固体物质的质量(如下表),
请分析表中数据,完成下列问题:
反应时间/min | 1.0 | 2.0 | 3.0 | 4.0 | 5.0 |
剩余固体质量/g | 5.20 | 4.60 | 4.20 | 4.10 | 4.08 |
(1)完全反应时,生成氧气的质量为_____g;
(2)原混合物中氯酸钾的质量分数是__________?(计算结果精确到0.1%)