题目内容
【题目】氢氧化钠和氢氧化钙是两种常见的碱,化学实验活动课上,同学们进行了如图所示的实验。
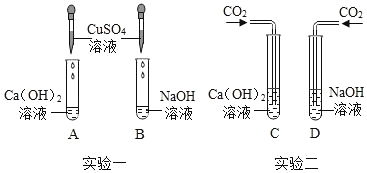
(1)实验一中,A、B 两支试管中共同的实验现象是__________________,其中B试管内发生反应的化学方程式为__________________。
(2)实验二中,C试管中有白色沉淀生成,该白色沉淀是___________(填化学式)。D试管中无现象,为了探究通入二氧化碳后D试管中溶质的成分,同学们进行了如下探究。
[提出猜想]猜想1:溶质是NaOH;猜想2:溶质是NaOH和Na2CO3;猜想3:溶质是Na2CO3。
[实验验证]
实验操作 | 实验现象 | 实验结论 |
①取D中少量溶液于试管中,加入过量稀盐酸 | _______________ | 猜想1不成立 |
②取D中少量溶液于试管中,加入过量的Ca(OH)2溶液,过滤,取滤液加入酚酞溶液 | 产生白色沉淀,酚酞溶液变红 | 猜想2成立 |
[反思与评价]
(1)小军评价实验操作②中加入Ca( OH)2溶液不正确,理由是__________________。
(2)实验室中氢氧化钠要密封保存的原因是____________________。
【答案】产生蓝色沉淀 ![]() CaCO3 产生气泡 碳酸钠和氢氧化钙反应生成氢氧化钠,影响对氢氧化钠的检验 防止氢氧化钠与空气中的二氧化碳反应生成碳酸钠而变质
CaCO3 产生气泡 碳酸钠和氢氧化钙反应生成氢氧化钠,影响对氢氧化钠的检验 防止氢氧化钠与空气中的二氧化碳反应生成碳酸钠而变质
【解析】
(1)氢氧化钠和硫酸铜反应生成蓝色的氢氧化铜沉淀和硫酸钠,氢氧化钙和硫酸铜反应生成蓝色的氢氧化铜沉淀和硫酸钙。在实验一中,A、B 两支试管中共同的实验现象是产生蓝色沉淀;B试管中,发生反应的化学方程式为:![]() ;
;
(2)氢氧化钠与二氧化碳反应生成碳酸钠和水,反应没有明显的实验现象;氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,实验中溶液变浑浊。实验二中,C试管中有白色沉淀生成,该白色沉淀是二氧化碳和氢氧化钙反应生成的碳酸钙,其化学式为:CaCO3;
[实验验证]
碳酸钠与盐酸反应生成氯化钠、水和二氧化碳。猜想1不成立,说明溶液中存在碳酸钠,加入稀盐酸后应有气泡产生。因此:
实验操作 | 实验现象 | 实验结论 |
①取D中少量溶液于试管中,加入过量稀盐酸 | 产生气泡 | 猜想1不成立 |
②取D中少量溶液于试管中,加入过量的Ca(OH)2溶液,过滤,取滤液加入酚酞溶液 | 产生白色沉淀,酚酞溶液变红 | 猜想2成立 |
[反思与评价]
(1)氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,氢氧化钠显碱性,能使酚酞溶液变红色;氯化钙与碳酸钠反应生成碳酸钙沉淀和氯化钠,氯化钠显中性,不能使酚酞溶液变红色。小军评价实验操作②中加入Ca(OH)2溶液不正确,理由是碳酸钠和氢氧化钙反应生成氢氧化钠,影响对氢氧化钠的检验;若要验证猜想2成立,需将Ca(OH)2溶液换成氯化钙溶液;
(2)在实验室中氢氧化钠固体密封保存的原因是氢氧化钠固体能够吸收空气中的水蒸气,能和空气中的二氧化碳反应生成碳酸钠和水。

【题目】某校兴趣小组在实验室中完成制取氧气的实验。他们取氯酸钾和二氧化锰的混合物共6g放入大试管中加热,并在同时测定试管中剩余固体物质的质量(如下表),
请分析表中数据,完成下列问题:
反应时间/min | 1.0 | 2.0 | 3.0 | 4.0 | 5.0 |
剩余固体质量/g | 5.20 | 4.60 | 4.20 | 4.10 | 4.08 |
(1)完全反应时,生成氧气的质量为_____g;
(2)原混合物中氯酸钾的质量分数是__________?(计算结果精确到0.1%)
【题目】操作和保存药品不当,标签常常易损毁。现有四瓶溶液①②③④的试剂标签已破损(如下图),但是已经知道这四瓶试剂是NaOH、Ca(OH)2、Na2CO3、KCl 溶液中的一种,某兴趣小组的同学决定对四瓶破损标签溶液成分进行实验探究(实验中另外的药品提供盐酸和酚酞溶液):
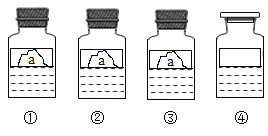
[提出问题]标签已经破损的①②③④四瓶溶液分别是什么溶液?
[实验探究1]第④瓶试剂肯定是_____(写化学式)。
[实验探究2]兴趣小组对①②③瓶溶液进行了如下的实验探究:
序号 | 实验步骤 | 实验现象 | 实验结论 |
1 | 取①②③瓶溶液少量于三支试管中,分别加入酚酞溶液 | _____ | 酚酞溶液不能将这三种溶液鉴别出来 |
2 | 再取①②③瓶溶液少量于另外三支试管中,分别加入_____溶液 | 盛有①溶液的试管中_____;其余两支试管中无明显现象 | ①瓶溶液为Na2CO3 |
3 | 取②③瓶溶液少量于两支试管中,分别加入_____溶液 | 盛有②溶液的试管中:_____;盛有③溶液的试管中:_____ | ②瓶溶液为_____ ③瓶溶液为Ca(OH)2 |