题目内容
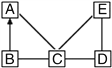
【题目】工业上利用黄铁矿(主要成分是FeS2)生产硫酸。同时还能得到一种副产品氧化铁用于炼铁,其反应原理为:①4FeS2+11O2![]() 2Fe2O3+8SO2 ②2SO2+O2
2Fe2O3+8SO2 ②2SO2+O2![]() 2SO3 ③SO3+H2O=H2SO4 ④ Fe2O3+3CO
2SO3 ③SO3+H2O=H2SO4 ④ Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
下列说法不正确的是
A. 反应①②④均有元素化合价发生变化 B. 四个反应的产物都有氧化物
C. 反应①④不属于四种基本反应类型中的任何一种 D. 反应②③属于化合反应
【答案】B
【解析】A、①中氧元素的化合价由0价变成-2价,铁元素的化合价由+2价变成+3价,硫元素的化合价由-1价变为+4价;②中硫元素由+4价变成+6价,氧气中的氧元素由0价变成-2价;④中铁元素由+3价变成0价,碳元素由+2价变成+4价,反应①②④均有元素化合价发生变化,正确;B、反应③的生成物是硫酸,是由三种元素组成的化合物,氧化物是由两种元素组成的,硫酸不属于氧化物,错误;C、①是由一种单质与一种化合物反应生成两种化合物,④是由两种化合物反应生成一种化合物与一种单质,均不属于基本反应类型,正确;D、反应②③都是由两种物质生成一种物质,属于化合反应,正确。故选B。

 小学课时特训系列答案
小学课时特训系列答案【题目】溶液与人们的生活息息相关。
(1)氯化钠、硝酸钾、氢氧化钙在不同温度时的溶解度如下表所示:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | 氯化钠 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
硝酸钾 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
氢氧化钙 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
①60℃时,氯化钠的溶解度____________硝酸钾的溶解度(填“>”、“<”或“=”)。
②氢氧化钙的饱和溶液加热后变浑浊,原因是____________________________________。
③20℃时,向氢氧化钙的饱和溶液中加入少量生石灰并恢复至20℃,溶液中溶质的质量 _________(填“增大”、“减小”或“不变”)。
④要从含有少量氯化钠的硝酸钾溶液中得到较多的硝酸钾,可以采用加热浓缩、________、过滤的方法,得到的滤液中含有_______________(填离子符号)。
(2)制作“叶脉书签”需要使用质量分数为10%的氢氧化钠溶液。用氢氧化钠固体配制50g质量分数为10%的氢氧化钠溶液,配制过程如下图所示:
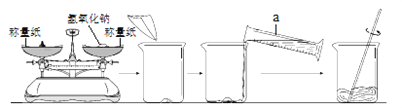
①写出图中标号仪器的名称:a______________。
②指出图中称量步骤的错误操作:_____________________________;_____________________________。
③若用质量分数为25%的氢氧化钠溶液配制50g质量分数为10%的氢氧化钠溶液,所需25%的氢氧化钠溶液和水的质量比为 ______。