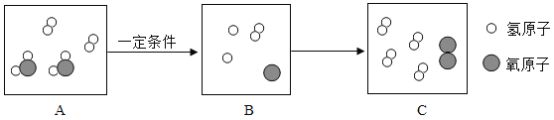
题目内容
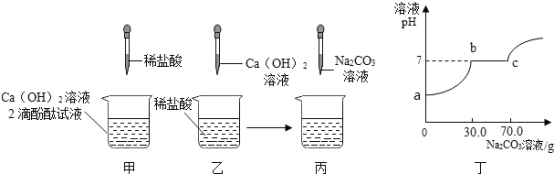
【题目】实验室有一瓶失去标签的溶液,知道只含有一种阳离子钾离子,为了弄清其到底含有几种溶质(都是初中常见的物质),四九芳华小组做了如下实验:(不考虑微溶和碳酸氢根)
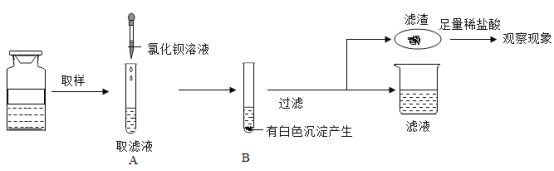
根据上述实验过程:小四同学根据滤渣处产生的_____________现象,从而确定了一定含有的两种溶质为___________,写出此过程反应的化学方程式:________。
还有那些溶质呢?小九同学继续探究如下图:
得出结论:该溶液一定含有氢氧化钾,请你对其结论进行评价_________;四九芳华小组经过讨论,觉得上述过程所加的试剂有一处不够明确和准确,从而对后续其他溶质的确定带来了影响,决定对一种试剂稍作调整,其他不变,调整为__________________,然后重新取滤液加入________,立即向所得溶液中加入__________,从而可推出瓶中溶液的溶质最多有__________种。
【答案】沉淀溶解 碳酸钾和氢氧化钾 ![]() 不正确,理由是碳酸钾显碱性,不能确定氢氧化钾和碳酸钾 硝酸钡 酚酞溶液 稀盐酸 2
不正确,理由是碳酸钾显碱性,不能确定氢氧化钾和碳酸钾 硝酸钡 酚酞溶液 稀盐酸 2
【解析】
碳酸根离子和钡离子生成碳酸钡沉淀,碳酸钡和稀硝酸反应生成硝酸钡、水和二氧化碳。
根据上述实验过程:A中加入氯化钡溶液,碳酸根离子和钡离子生成碳酸钡沉淀,有白色沉淀产生,过滤,滤渣加入足量的稀硝酸,滤渣处产生的沉淀溶解现象,从而确定了一定含有的两种溶质为碳酸钾和氢氧化钾,此过程反应是碳酸钡和稀硝酸反应生成硝酸钡、水和二氧化碳,反应的化学方程式为![]() 。
。
得出结论:碳酸钾显碱性,能使酚酞溶液变红,故该溶液一定含有氢氧化钾是不准确的,理由是碳酸钾显碱性,不能确定氢氧化钾和碳酸钾;实验过程要消除碳酸根离子的干扰,碳酸钾和硝酸钡反应生成碳酸钡和硝酸钾,硝酸钾和硝酸钡溶液都呈中性,都不能使酚酞溶液变色,故将氯化钡溶液调整为硝酸钡,然后重新取滤液加入酚酞溶液,立即向所得溶液中加入稀盐酸,从而可推出瓶中溶液的溶质可能是碳酸钾、氢氧化钾,最多有2种。

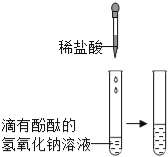
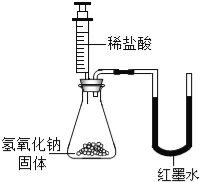
【题目】某化学兴趣小组的同学往氢氧化钠溶液中滴加稀盐酸时,没有看到明显现象.
(提出问题)氢氧化钠与盐酸是否发生了化学反应?
(查阅资料)酸与碱发生中和反应会放出热量.
(实验设计)甲、乙、丙三位同学分别设计了如下实验方案,请你帮他们完成实验报告.
同学 | 实验操作 | 现象 | 结论 |
甲 |
| 溶液由红色变成 | 氢氧化钠与盐酸发生了化学反应,反应的化学方程式为 |
乙 |
| U型玻璃管中 边的红墨水液面下降(所加稀盐酸的体积忽略不计) | 氢氧化钠与盐酸发生了化学反应 |
丙 | 用 测定氢氧化钠溶液的pH,向其中滴加足量稀盐酸,再测定溶液的pH | 最后溶液的pH (填“≥7”、“≤7”、“不变” | 氢氧化钠与盐酸发生了化学反应 |
(评价反思)你认为实验设计方案不合理的同学是 ,理由是 .
(拓展延伸)另有一位同学向自己配制的氢氧化钠溶液中滴加酚酞试液时,溶液变红色,可是红色即可消失了,出现此意外情况的原因是 (填以下序号).
A.所用的酚酞试液是变质的
B.所用的氢氧化钠溶液浓度太小
C.氢氧化钠溶液吸收了空气中二氧化碳