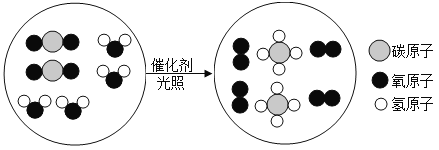
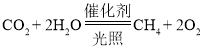题目内容
【题目】学习小组测定某工业废水中 H2SO4的含量。取 100g 废水于烧杯中,加入200gBaCl2 溶液,恰好完全反应,经过滤得到 253.4g 溶液(H2SO4 + BaCl2 = BaSO4 ↓+2HCl)(可溶性杂质不参加反应,过滤后滤液的损失忽略不计)
(1)充分反应后生成沉淀的质量为______g;
(2)该工业废水中硫酸的质量分数为____________?(写出计算过程)
【答案】46.6 19.6%
【解析】
由质量守恒定律可知,反应物的总质量等于生成物的总质量,减少的是生成的气体或沉淀的质量。
(1)由质量守恒定律可知,反应物的总质量等于生成物的总质量,减少的是生成的气体或沉淀的质量,故充分反应后生成沉淀的质量为![]()
(2)设工业废水中硫酸的质量分数为x
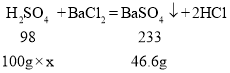
![]()
![]()
则该工业废水中硫酸的质量分数为19.6%
答:充分反应后生成沉淀的质量为46.6g,该工业废水中硫酸的质量分数为19.6%。

【题目】某化学兴趣小组的同学往氢氧化钠溶液中滴加稀盐酸时,没有看到明显现象.
(提出问题)氢氧化钠与盐酸是否发生了化学反应?
(查阅资料)酸与碱发生中和反应会放出热量.
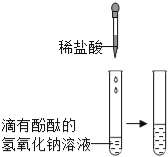
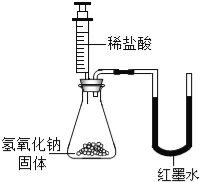
(实验设计)甲、乙、丙三位同学分别设计了如下实验方案,请你帮他们完成实验报告.
同学 | 实验操作 | 现象 | 结论 |
甲 |
| 溶液由红色变成 | 氢氧化钠与盐酸发生了化学反应,反应的化学方程式为 |
乙 |
| U型玻璃管中 边的红墨水液面下降(所加稀盐酸的体积忽略不计) | 氢氧化钠与盐酸发生了化学反应 |
丙 | 用 测定氢氧化钠溶液的pH,向其中滴加足量稀盐酸,再测定溶液的pH | 最后溶液的pH (填“≥7”、“≤7”、“不变” | 氢氧化钠与盐酸发生了化学反应 |
(评价反思)你认为实验设计方案不合理的同学是 ,理由是 .
(拓展延伸)另有一位同学向自己配制的氢氧化钠溶液中滴加酚酞试液时,溶液变红色,可是红色即可消失了,出现此意外情况的原因是 (填以下序号).
A.所用的酚酞试液是变质的
B.所用的氢氧化钠溶液浓度太小
C.氢氧化钠溶液吸收了空气中二氧化碳