题目内容
【题目】进行如下微型实验,研究物质的性质。
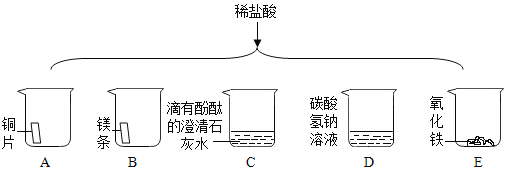
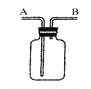
(1)能产生黄色溶液的化学反应方程式是 _______________________。
(2)能证明C中发生反应的现象是______________________。
(3)由A和B对比能得出有关金属活动性的结论是 _________________________。
【答案】Fe2O3+6HCl═2FeCl3+3H2O 溶液由红色变成无色 镁的金属活动性比铜强
【解析】
显酸性、显中性溶液不能使酚酞试液变色,显碱性溶液能使酚酞试液变红色。
(1)根据含有铁离子的溶液显黄色,盐酸和氧化铁反应生成氯化铁和水,氯化铁溶液显黄色,反应的方程式为:Fe2O3+6HCl═2FeCl3+3H2O。故填:Fe2O3+6HCl═2FeCl3+3H2O;
(2)氢氧化钙显碱性,能使酚酞溶液变红;C中氢氧化钙和盐酸反应生成氯化钙和水,氢氧化钙完全反应后溶液显中性(氢氧化钙和稀盐酸恰好完全反应)或显酸性(稀盐酸过量),显中性或显酸性溶液不能使酚酞试液变色,因此发生反应的现象是溶液由红色变成无色。故填:溶液由红色变成无色;
(3)A中铜不能与稀盐酸反应,没有现象,B中镁和稀盐酸反应有气泡生成,说明金属活动性镁>氢>铜。故填:镁的金属活动性比铜强。

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目