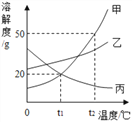
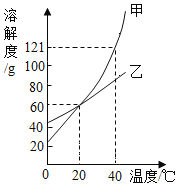
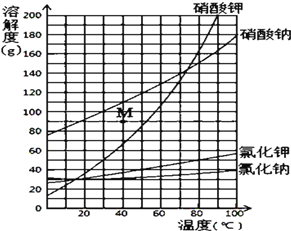
题目内容
【题目】取18.6g氢氧化钠样品(样品中的杂质是碳酸钠),加水溶解得到溶液A,取A溶液的![]() 向其中逐滴加入一定浓度的稀盐酸,并同时记录放出CO2的质量和消耗盐酸的质量(所得数据如下图)。试计算:
向其中逐滴加入一定浓度的稀盐酸,并同时记录放出CO2的质量和消耗盐酸的质量(所得数据如下图)。试计算:
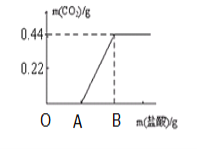
(A点横坐标为7.3,B点横坐标为14.6)
(1)AB段(不含A点)的反应化学方程式为____________________________。
(2)样品中碳元素的质量分数为___________。(精确到0.1%)
(3)14.6g盐酸中溶质的质量为多少_________?(写出计算过程)
【答案】 Na2CO3+2HCl=2NaCl+H2O+CO2↑ 6.5% 1.46g。
【解析】(1)OA段没有二氧化碳生成,是由于稀盐酸和氢氧化钠反应,当氢氧化钠反应完全后,稀盐酸与碳酸钠反应,故AB段是稀盐酸与碳酸钠反应生成二氧化碳、水和氯化钠,反应方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑
(2)由图可知,生成二氧化碳的质量为0.44g,0.44g二氧化碳中碳元素的质量为0.44g![]() =0.12g,故样品中碳元素的质量分数为
=0.12g,故样品中碳元素的质量分数为![]() 100%=6.5%
100%=6.5%
(3)有图可知与碳酸钠反应的稀盐酸的质量为7.3g,设7.3g的稀盐酸增加溶质的为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
73 44
y 0.44
![]() =
=![]() ,解得,y=0.73g,故14.6g的稀盐酸中含有溶质的质量为0.73g
,解得,y=0.73g,故14.6g的稀盐酸中含有溶质的质量为0.73g![]() =1.46g。
=1.46g。

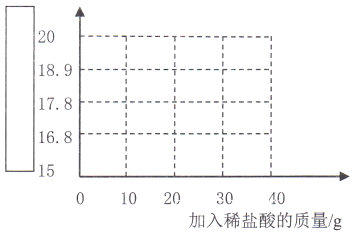
【题目】某补钙剂说明书的部分信息如图所示,现用20片该药剂制成的固体粉末与40g稀盐酸混合(其他成分不与盐酸反应),稀盐酸平均分成4次加入烧杯中,实验数据见下表:

实验序号 | 加入稀盐酸的质量/g | 固体粉末剩余质量/g |
1 | 10 | 18.9 |
2 | 10 | 17.8 |
3 | 10 | 16.8 |
4 | 10 | m |
(1)该瓶补钙剂属于__________。(填物质分类)
(2)表格中的m=________。
(3)求稀盐酸的浓度____________。(请根据化学方程式写出完整的计算步骤)
(4)该瓶补钙剂含有碳酸钙________g。(结果保留1位小数)
(5)请根据上述内容,在下图中补全图像。
 ___________
___________