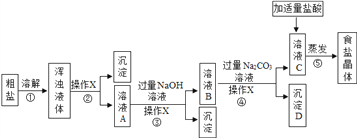
题目内容
【题目】我国劳动人民早在五千年前就会使用木炭炼铜。某化学兴趣小组在实验宝里模拟炼铜,开展如下图所示的探究活动。
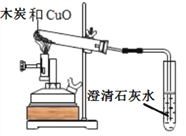
Ⅰ.验证单质碳的还原性
(1)加热固体,2min后,观察到固体变红或澄清石灰水__________,证明碳具有还原性。
(2)CuO发生________反应(填“氧化”或还原”)
(3)反应结束时,停止实验的第一步操作是__________________。
Ⅱ,探究反应后红色固体的成分
【查阅资料】(1)木炭与CuO的反应是:C+2CuO高温2Cu+CO2↑,若该反应进行的不彻底,产物中可能还含有氧化亚铜(Cu2O)。
(2)Cu2O是红色固体,能与稀硫酸反应Cu2O +H2SO4=Cu+ Cu SO4+H2O
【作出猜想】红色体的成分: a全部是Cu ;b.全部是Cu2O ;c.全部是___________
【实验步骤】取试管内红色同体,进行如下实验验证:
①取1.44g红色固体装入试管,滴入足量稀硫酸,观察到红色体部分减少,溶液变为____色,则猜想a错误。
②过滤,滤出试管中残留的红色固体,干燥,称其质为1.04g,则猜想______正确。理由是____________。
【评价反思】在的铜冶炼史中,我国劳动人民还有一项重大发明就是“湿法炼铜”,该方可用化学方程式表示为_____________________________。
【答案】 变浑浊 还原 将导管从试管中移出 既有Cu也有Cu2O 蓝 c 若有1.44g的氧化亚铜反应会生成0.64g的铜,而实际收集到的铜的质量为1.04g,故1.44g是氧化亚铜和铜的混合物。 Fe+CuSO4═FeSO4+Cu
【解析】Ⅰ.验证单质碳的还原性:(1) 据反应C+2CuO![]() 2Cu+CO2↑可知,反应过程中有二氧化碳产生,故石灰水会变浑浊,证明碳具有还原性;(2)由(1)分析可知,CuO发生还原反应;(3)反应结束时,停止实验的第一步操作是:将导管从试管中移出;【作出猜想】红色固体的成分:③既有Cu也有Cu2O;【实验探究】①红色固体部分减少,推测含有Cu2O,故滴入的应是稀硫酸,氧化亚铜与稀硫酸反应生成硫酸铜、铜和水,故溶液变为蓝色,所以猜想a错误;②由化学方程式Cu2O+H2SO4═Cu+CuSO4+H2O知,每144份质量的氧化亚铜反应会生成64份质量的铜,若有1.44g的氧化亚铜反应会生成0.64g的铜,而实际收集到的铜的质量为1.04g,故1.44g是氧化亚铜和铜的混合物。【评价反思】现代湿法冶金术的先驱,早在西汉时期刘安在《淮南万毕术》中写到“曾青(CuSO4)得铁则化为铜”,其中的“曾青”就是指硫酸铜。这句话的意思就是说:硫酸铜溶液遇到金属铁时,铁与硫酸铜发生置换反应能生成金属铜,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu。
2Cu+CO2↑可知,反应过程中有二氧化碳产生,故石灰水会变浑浊,证明碳具有还原性;(2)由(1)分析可知,CuO发生还原反应;(3)反应结束时,停止实验的第一步操作是:将导管从试管中移出;【作出猜想】红色固体的成分:③既有Cu也有Cu2O;【实验探究】①红色固体部分减少,推测含有Cu2O,故滴入的应是稀硫酸,氧化亚铜与稀硫酸反应生成硫酸铜、铜和水,故溶液变为蓝色,所以猜想a错误;②由化学方程式Cu2O+H2SO4═Cu+CuSO4+H2O知,每144份质量的氧化亚铜反应会生成64份质量的铜,若有1.44g的氧化亚铜反应会生成0.64g的铜,而实际收集到的铜的质量为1.04g,故1.44g是氧化亚铜和铜的混合物。【评价反思】现代湿法冶金术的先驱,早在西汉时期刘安在《淮南万毕术》中写到“曾青(CuSO4)得铁则化为铜”,其中的“曾青”就是指硫酸铜。这句话的意思就是说:硫酸铜溶液遇到金属铁时,铁与硫酸铜发生置换反应能生成金属铜,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu。