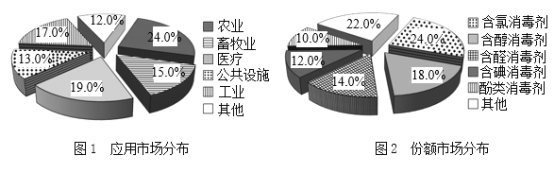
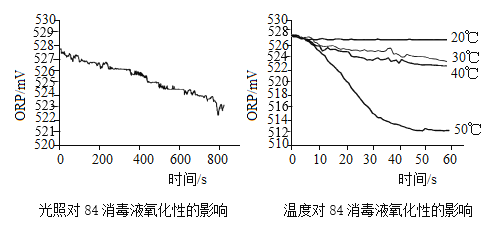
题目内容
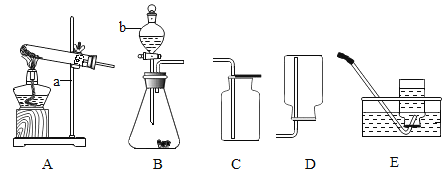
【题目】实验室常用MnO2与浓盐酸反应制备C12,反应的化学方程式为![]() ,反应装置如图1所示。
,反应装置如图1所示。
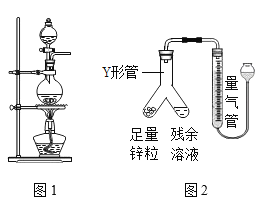
(1)检查装置气密性之后的操作依次是_________(填字母)。
A向烧瓶中加入MnO2粉末
B加热
C向烧瓶中加入浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余溶液中盐酸的浓度,探究小组同学提出下列实验方案:
①甲同学的方案:利用盐酸和硝酸银反应,化学方程式为______________,利用残余溶液与足量的AgNO3溶液反应,称量生成沉淀的质量,可以测出反应残余溶液中盐酸的浓度。此方案是否可行,请说明原因:______________________。
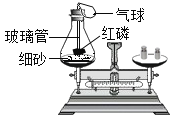
②乙同学的方案:与足量Zn反应,测量生成的气体体积。实验装置如图2所示(夹持装置已略去)。使Y形管中的残余溶液与锌粒反应的正确操作是将_____________转移到_________________中。
【答案】ACB HCl+AgNO3=AgCl↓+HNO3 不可行,二氧化锰与浓盐酸反应生成氯化锰,氯化锰也会与硝酸银反应 锌粒 残留溶液
【解析】
(1)加药顺序一般是先加入固体药品,再加入液药品,最后再加热,检查装置气密性后,先加入固体,再加入液体浓盐酸,然后加热,则依次顺序是ACB。
(2)①盐酸和硝酸银反应生成氯化银沉淀和硝酸,反应的化学方程式为:HCl+AgNO3=AgCl↓+HNO3;二氧化锰与浓盐酸反应生成氯化锰,氯化锰也会与硝酸银反应,不能测出反应残余溶液中盐酸的浓度,所以甲方案错误,不可行;
②与足量Zn反应,依据锌粒与稀盐酸反应生成氢气,该化学反应释放热量,气体体积具有热胀冷缩的特点,使Zn粒进入残余清液中让其发生反应,这样残余清液就可以充分反应,如果反过来,残余清液不可能全部转移到左边,若残余清液转移到左边则会残留在V型管内壁,导致产生气体的量减少,使测定的盐酸浓度偏小。根据装置图,通过旋转Y型管,将锌粒转移到残留溶液中,反应即可进行;

 挑战100单元检测试卷系列答案
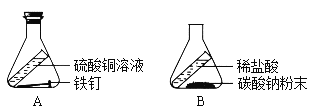
挑战100单元检测试卷系列答案【题目】质量守恒定律能够用实验验证:(从A或B中任选一个作答。)
A | B |
|
|
用上述实验,验证质量守恒定律(实验前后利用天平称量质量)。 实验过程中气球的变化为_____;充分反应并冷却后,天平仍保持平衡,从微观的角度解释其原因:_____。 | 某兴趣小组同学利用上述实验,验证质量守恒定律(实验前后利用天平称量质量)。 A、B实验中,不能验证质量守恒定律的有_____,原因是_____。 |