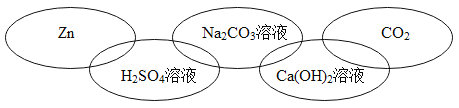
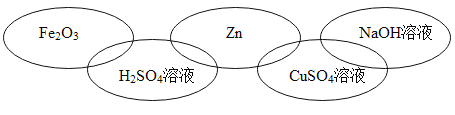
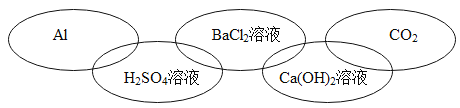
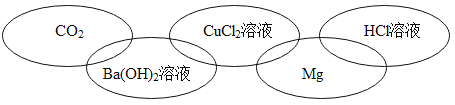
题目内容
【题目】以工业CuO(含少量FeO)、工业盐酸(含少量稀硫酸)为原料,生产CuCl2·2H2O工艺流程如下。
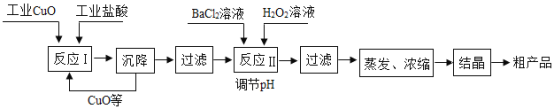
(1)反应Ⅰ中发生了金属氧化物与酸的反应,化学方程式为_____(写一个即可)。
(2)为了加快反应Ⅰ中的反应速度,可以适当加热,但是温度不能过高,原因是__。
(3)反应Ⅱ中发生的3个反应为:
①FeSO4+BaCl2=BaSO4↓+FeCl2;
②CuSO4+BaCl2=BaSO4↓+CuCl2;
③2FeCl2+H2O2+4H2O=2Fe(OH)3↓+4HCl,
其中属于复分解反应的是____(填序号)。
【答案】CuO+2HCl=CuCl2+H2O(或FeO+2HCl=FeCl2+H2O) 盐酸易挥发,温度越高,挥发越快 ①②
【解析】
(1)氧化铜与盐酸反应生成氯化铜和水,氧化亚铜与盐酸反应生成氯化亚铁和水,化学方程式为:CuO+2HCl=CuCl2+H2O(或FeO+2HCl=FeCl2+H2O);
(2)盐酸具有挥发性,温度越高,分子运动速率越快,盐酸挥发越快,将不利于反应的进行,所以需要控制温度,避免盐酸过度挥发;
(3)①、两种反应物相互交换了组分,并有沉淀生成,①属于复分解反应;
②、两种反应物相互交换了组分,并有沉淀生成,②属于复分解反应;
③、反应物为三种,且不是互换组分,虽有沉淀生成,但③不是复分解反应。
故填:①、②。

【题目】CaCO3广泛存在于自然界,是一种重要的化工原料。某种大理石除主要成分CaCO3外,还含有少量的硫化钙。小李和小明同学用这种大理石和盐酸反应,分别开展以下探究,请你参与探究并回答相关问题。
[查阅资料]
资料一:已知复分解反应![]() 可自发进行。在常温下,测得浓度为a%的下列五种溶液的pH大小情况如下表所示:
可自发进行。在常温下,测得浓度为a%的下列五种溶液的pH大小情况如下表所示:
溶质 | H2SO4 | HCl | H2S | H2CO3 | HClO |
pH | 小→大 | ||||
表中pH大小情况揭示出复分解反应的一条规律,即较强酸发生类似反应可以生成较弱酸。下列反应均能发生,其中不符合该规律的是_____________(填字母代号)。
A![]()
B![]()
C![]()
D![]()
资料二:常见的干燥剂有①浓硫酸、②无水氯化钙、③氢氧化钠固体、④生石灰、⑤五氧化二磷。
[实验探究]小茜同学为了得到纯净的二氧化碳,设计了如图所示装置,请你分析:
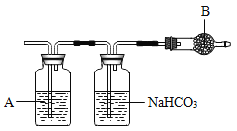
(1)制备的二氧化碳气体中,可能含有的杂质是____________。
(2)上述装置中,A是______________溶液,NaHCO3溶液可以吸收_____________。
(3)上述装置中,B物质不可能是_________(填字每代号)。
A五氧化二磷 B无水氯化钙 C氢氧化钠固体 D生石灰
(4)如果B失效,则得到的二氧化碳质量__________(“偏高”“偏低”或“不受影响”)。