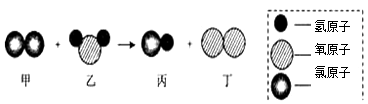
题目内容
【题目】下列4个图象能正确反映对应的实验操作的是( ) 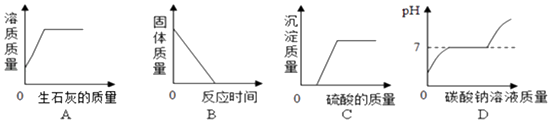
A.向一定量的饱和Ca(OH)2溶液中加入一定量的生石灰
B.向一定量的CuO中通入CO气体并加热
C.向一定量的KOH和Ba(NO3)2的混合溶液中,逐滴加入稀H2SO4
D.向一定量的HCl和CaCl2(CaCl2溶液呈中性)的混合液中加入Na2CO3溶液
【答案】D
【解析】解:A、向一定量的饱和Ca(OH)2溶液中加入一定量的生石灰,水会与氧化钙反应生成氢氧化钙,溶剂的质量减少,溶质质量也会相应的减少,然后不变,故A错误; B、一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳,反应后固体的质量不会减小到零,故B错误;
C、硫酸根离子和钡离子一接触就会生成硫酸钡沉淀,所以沉淀质量应该从零开始逐渐增大,然后不变,故C错误;
D、向一定量的HCl和CaCl2(CaCl2溶液呈中性)的混合液中加入Na2CO3溶液,碳酸钠会先与盐酸反应,再与氯化钙反应,所以溶液的pH值先增大,然后不变,在继续增大,故D正确.
故选:D.
【考点精析】通过灵活运用一氧化碳的性质,掌握一氧化碳的物理性质:无色,无味的气体,密度比空气略小,难溶于水;一氧化碳的化学性质:可燃性和还原性即可以解答此题.

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】氧化镁在医药、建筑等行业应用广泛,以菱镁矿(主要成分为MgCO3 , 含少量FeCO3 , 其他杂质不溶,也不参加反应)为原料制备高纯氧化镁的实验流程如图1: 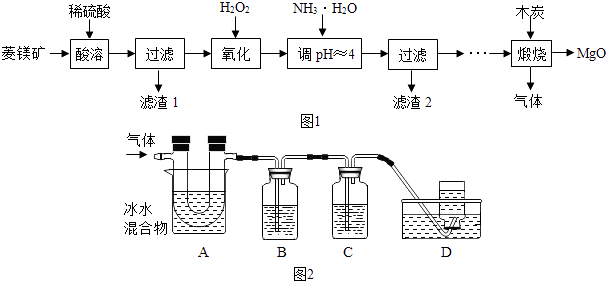
资料:①不同氢氧化物沉淀的pH范围:
氢氧化物 | Fe(OH)3 | Mg(OH)2 |
开始沉淀的pH | 1.5 | 8.6 |
完全沉淀的pH | 3.2 | 11.1 |
②硫在常温下是一种淡黄色固体,硫的熔点约为115.2℃,沸点约为444.7℃;
③高锰酸钾溶液只吸收SO2 , 不吸收CO2;
④碱溶液既吸收SO2 , 又吸收CO2 .
试回答下列问题:
(1)MgCO3与稀硫酸反应的化学方程式为 .
(2)加入H2O2目的是在酸性条件下将FeSO4氧化成Fe2(SO4)3 , 同时生成水,发生反应的化学方程式为 .
(3)加氨水调节溶液的pH约为4的目的是 , 反应的化学方程式为 .
(4)煅烧过程存在以下反应: 2MgSO4+C ![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C ![]() MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C ![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用如图2装置对煅烧产生的气体进行分步吸收或收集.(假设每步反应都完全进行)
①A中现象是:玻璃管壁出现色固体;
②B中盛放的溶液可以是(填字母),实验现象为;
a.Ca(OH)2 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③D中收集的气体是(填化学式).