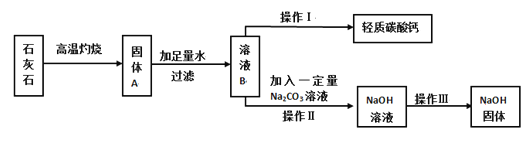
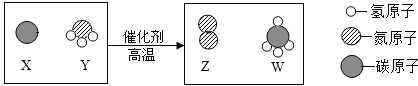
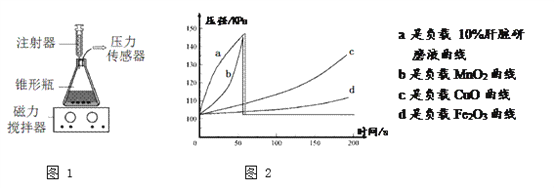
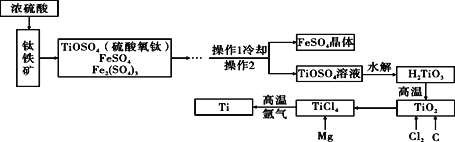
题目内容
【题目】我国有漫长的海岸线,海洋蕴藏着丰富的资源。请按要求填空。
(1)海洋为我们提供了营养丰富的食材。鱼虾富含的______是机体生长及修补受损组织的主要原料,海带富含的_______可以预防甲状腺肿大。
(2)今年5月我国在海域可燃冰开采技术领域取得重大突破。可燃冰主要含有甲烷水合物,还含少量CO2等气体,可燃冰属于__________(选填“纯净物”或“混合物”)。甲烷燃烧的化学方程式为______。
(3)镁在海水中主要以MgCl2的形式存在,MgCl2中Mg的化合价是_________。
(4)海水淡化可缓解淡水资源匮乏问题。
①水变成水蒸气的过程中,发生变化的是_______(选填序号)。
A.分子个数 B.分子质量 C.分子间隔 D.分子种类
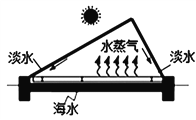
②利用下图装置得到淡水的方法与实验室通过_______(选填“沉淀”、“过滤”或“蒸馏”)净化水的方法原理相同。
(5) 海水碳储存,可以缓解空气中CO2过多的问题,但海水的pH也在逐渐减小,同时软体生物贝壳也在逐渐软化、变薄缩小。
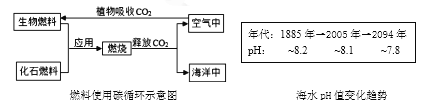
根据海水pH变化趋势判断:2000年时海水呈________性。
【答案】 蛋白质 碘 混合物 CH4 +2O2=CO2+2H2O +2 C 蒸馏 碱
【解析】(1)肉、蛋、奶类食品都能提供丰富的蛋白质,蛋白质是机体生长及修补受损组织的主要原料,海带富含的碘元素可以预防甲状腺肿大;(2)可燃冰由多种物质组成,属于混合物,主要成分是甲烷,甲烷和氧气点燃条件下反应生成二氧化碳和水,化学方程式为CH4 + 2O2 ![]() CO2 +2 H2O;(3)化合物中元素的化合价代数和为零,MgCl2中氯元素显-1价,所以Mg的化合价是+2;(4)①水变成水蒸气的过程中,没有新的物质生成,是物理变化,分子的种类不变,因而分子的质量、体积、个数也不变,改变的只是分子间的间隔和排列方式,故选C;②利用如图装置得到淡水的方法是将水蒸发,然后再冷凝,通过此过程使水与可溶性物质分离而得打纯水,与实验室通过蒸馏净化水的方法原理相同;(5)溶液的pH小于7,溶液呈酸性,pH越小,酸性越强;溶液的pH大于7,溶液呈碱性,pH越大碱性越强;pH等于7,溶液呈中性。根据海水pH变化趋势判断:2000年时海水的pH大于7,呈碱性。
CO2 +2 H2O;(3)化合物中元素的化合价代数和为零,MgCl2中氯元素显-1价,所以Mg的化合价是+2;(4)①水变成水蒸气的过程中,没有新的物质生成,是物理变化,分子的种类不变,因而分子的质量、体积、个数也不变,改变的只是分子间的间隔和排列方式,故选C;②利用如图装置得到淡水的方法是将水蒸发,然后再冷凝,通过此过程使水与可溶性物质分离而得打纯水,与实验室通过蒸馏净化水的方法原理相同;(5)溶液的pH小于7,溶液呈酸性,pH越小,酸性越强;溶液的pH大于7,溶液呈碱性,pH越大碱性越强;pH等于7,溶液呈中性。根据海水pH变化趋势判断:2000年时海水的pH大于7,呈碱性。

 阅读快车系列答案
阅读快车系列答案【题目】碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业。某化学兴趣小组的同学对碳酸氢钠的性质进行了如下探究。
实验一:探究碳酸氢钠溶液的酸碱性用pH试纸测得碳酸氢钠溶液的pH=10,由此可知:当向碳酸氢钠溶液中滴加紫色的石蕊试液时,溶液呈_______色。
实验二:探究碳酸氢钠的热稳定性
[查阅资料]:碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质。
[进行实验]:为验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠放到铜片上加热,如下图所示。

(1)加热一段时间后,观察到烧杯内壁有_______________。
(2)兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3。
①他们猜想的依据是____________________________。
②为探究反应后的固体产物到底是NaOH还是Na2CO3,他们又进行了如下表的实验并得到结论,请你完成下表。
实 验 操 作 | 实验现象 | 结 论 |
_______________ | ____________ | 固体产物是Na2CO3 |