题目内容
将16g含有杂质的锌粒投入到盛有足量稀硫酸的烧杯中(杂质跟稀硫酸不反应).测得加入锌粒前烧杯和稀硫酸的总质量为200g,反应停止后,烧杯和烧杯内剩余物的总质量为215.6g.求:
(1)反应中生成氢气的质量;
(2)这16g含杂质的锌粒中金属锌的质量分数.
(1)0.4g;(2)81.25%
解析试题分析: (1)根据质量守恒定律,反应中生成氢气的质量=16g+200g﹣215.6g=0.4g;
(2)设含杂质的锌粒中金属锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.4g =
= x=13g
x=13g
这16g含杂质的锌粒中金属锌的质量分数= ×100%=81.25%
×100%=81.25%
考点:含杂质物质的化学反应的有关计算;根据化学反应方程式的计算

练习册系列答案
相关题目
某环保小组监测到化工厂排放的废水中含有盐酸和氯化镁两种污染物,为测定该废水中各污染物的含量,环保小组进行了以下实验:
【实验一】取废水100g,向其中加入溶质质量分数为10%的氢氧化钠溶液。测得沉淀质量与所加入氢氧化钠溶液质量的关系如图。请根据实验及有关数据分析和计算: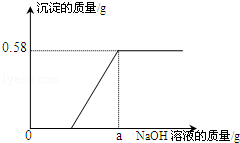
(1)向100g该废水中加入足量的氢氧化钠溶液时,产生的沉淀质量为 g。
(2)求该废水中氯化镁溶质的质量分数是多少?
【实验二】取三份废水各100g,分别缓慢加入到20g、40g和60g某硝酸银溶液中,测得三组实验数据见下表:
| | 第一组 | 第二组 | 第三组 |
| 硝酸银溶液的质量/g | 20 | 40 | 60 |
| 生成沉淀的质量/s | 2.870 | 5.740 | 7.175 |
(3)100g废水中加入硝酸银溶液的质量为 g时,可恰好完全反应。
(4)【实验一】图示中,a的数值为 。




