题目内容
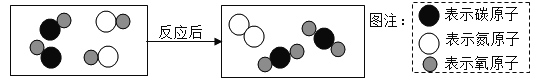
【题目】推断题:有一无色液体A,在通电条件下,可以产生B和H两种单质气体;E是红色固体单质,其它关系如图所示,请完成下列问题:
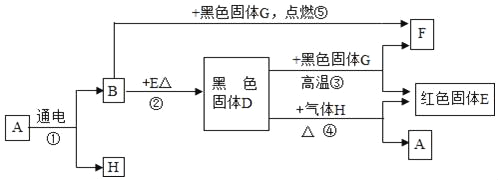
(1)写出有关物质的化学式:H是_____,G是_____;
(2)写出反应③的化学方程式_____;化学反应④的化学方程式_____
(3)写出用澄清石灰水检验F气体的化学方程式_____
(4)化学反应②的基本反应类型_____,红色固体单质E在日常生活中常用作_____。
【答案】H2 C C+2CuO![]() 2Cu+CO2↑ H2+CuO
2Cu+CO2↑ H2+CuO![]() Cu+H2O CO2+Ca(OH)2=CaCO3↓+H2O 化合反应 导线
Cu+H2O CO2+Ca(OH)2=CaCO3↓+H2O 化合反应 导线
【解析】
无色液体A,在通电条件下,可以产生B和H两种单质气体,所以A是水,E是红色固体单质,所以E是铜,铜和氧气加热生成氧化铜,所以D是氧化铜,B是氧气,H是氢气,氧化铜和氢气在加热的条件下生成铜和水,氧化铜和黑色固体高温生成F和铜,所以G是碳,F是二氧化碳,碳和氧气在点燃的条件下生成二氧化碳,经过验证,推导正确,
(1)由上分析可知H是氢气,故填H2;G是碳,故填C;
(2)反应③是碳和氧化铜在高温的条件下生成铜和二氧化碳,化学方程式故填C+2CuO![]() 2Cu+CO2↑;反应④是氧化铜和氢气在加热的条件下生成铜和水,化学方程式故填H2+CuO
2Cu+CO2↑;反应④是氧化铜和氢气在加热的条件下生成铜和水,化学方程式故填H2+CuO![]() Cu+H2O;
Cu+H2O;
(3)用澄清石灰水检验F气体的反应是二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,化学方程式故填CO2+Ca(OH)2=CaCO3↓+H2O;
(4)反应②是铜和氧气在加热的条件下生成氧化铜,属于基本反应类型中的化合反应,故填化合反应;红色固体单质E是铜,在日常生活中常用作导线,故填导线。

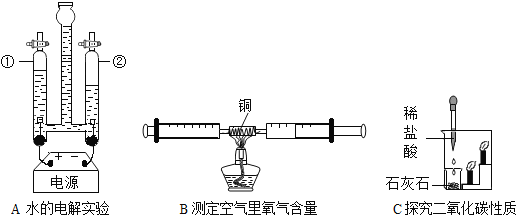
【题目】1775年法国化学家拉瓦锡用定量的方法研究了空气的成分。仿照这个历史上著名实验的原理,如今我们的化学教育家积极探索、不断创新,先后设计出了如图所示的实验装置。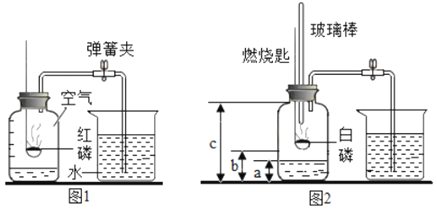
(提出问题)用红磷燃烧的方法为什么测出的氧气含量远低于21%?
(分析讨论)(1)实验装置漏气;(2)______,导致装置内氧气有剩余;(3)……
(实验改进)(1)如图2所示的实验装置进行实验探究。实验前在集气瓶里先装进a体积的水,其作用:一是为了加快集气瓶的冷却速度;二是______。
(2)如图3所示的实验装置进行实验探究。
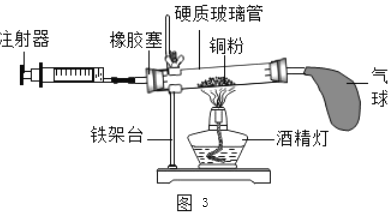
①在实验过程中,不断推拉注射器的目的是______。
②写出该实验中反应的化学方程式______。
③测得实验结果如下(气体体积):(单位:mL)
反应前玻璃管内 | 反应前注射器内 | 反应后注射器内 |
40 | 30 | 18 |
由此数据可以推算出他测定的空气中氧气的体积分数为______。
(实验结论)(1)研究空气的成分实验是在密封容器内进行。
(2)该物质在空气中可以燃烧且只与空气中的氧气反应。
(3)燃烧后的产物______。