题目内容
【题目】在烧杯中加入2.4g久置的铝箔,再滴加稀硫酸,铝箔全部溶解,放出气体的质量与所加稀硫酸质量的关系如图所示,请回答下列问题:
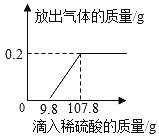
(1)产生氢气的质量为______g。
(2)计算2.4g久置的铝箔中金属铝的质量分数(写出计算过程);
(3)实验刚开始没有气泡产生的原因是______,久置的铝箔与稀硫酸恰好完全反应时所得溶液只有一种溶质,这种溶质是______(用化学式填空),此时溶液质量为______g。
【答案】0.2 久置的铝箔表面被氧化,形成一层氧化膜。此氧化膜与硫酸反应生成硫酸铝和水,不产生氢气 Al2(SO4)3 110
【解析】
根据铝箔和稀硫酸反应化学方程式,结合题干中的右图所示,看出开始加稀硫酸没产生氢气,当加入9.8g稀硫酸时才产生氢气,说明久置的铝箔表面被氧化,当加稀硫酸的量至107.8g时,铝箔和硫酸恰好完全反应,产生0.2g氢气,再根据所产生氢气的质量求出参加反应的铝的质量,那么题干中的求答问题就会迎刃而解。
解:(1)根据铝箔和稀硫酸反应化学方程式,结合题干中的右图所示知道产生氢气的质量是0.2g,
(2)设生成0.2g氢气需要铝的质量为x,
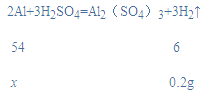
![]()
x=1.8g,
2.4g久置的铝箔中金属铝的质量分数为![]() ×100%=75%;
×100%=75%;
(3)刚开始滴加稀硫酸没有氢气放出的原因是:久置的铝箔表面被氧化,形成一层氧化膜,此氧化膜与硫酸反应生成硫酸铝和水,不产生氢气;由于铝与硫酸反应生成硫酸铝和氢气,氧化铝和硫酸反应生成硫酸铝和水,所以久置的铝箔与稀硫酸恰好完全反应时所得溶液只有一种溶质为硫酸铝,根据质量守定律可知,此时溶液质量为2.4g+107.8g-0.2g=110g。

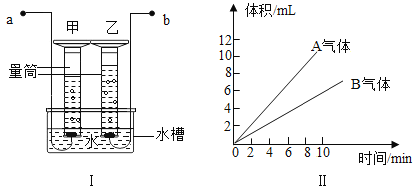
【题目】1775年法国化学家拉瓦锡用定量的方法研究了空气的成分。仿照这个历史上著名实验的原理,如今我们的化学教育家积极探索、不断创新,先后设计出了如图所示的实验装置。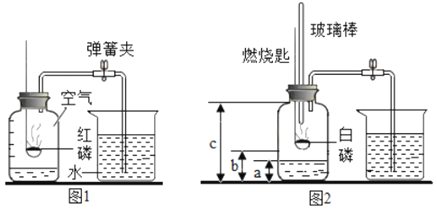
(提出问题)用红磷燃烧的方法为什么测出的氧气含量远低于21%?
(分析讨论)(1)实验装置漏气;(2)______,导致装置内氧气有剩余;(3)……
(实验改进)(1)如图2所示的实验装置进行实验探究。实验前在集气瓶里先装进a体积的水,其作用:一是为了加快集气瓶的冷却速度;二是______。
(2)如图3所示的实验装置进行实验探究。
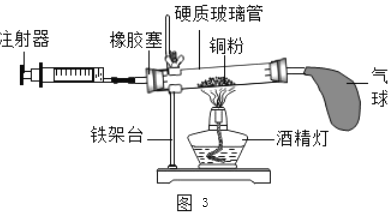
①在实验过程中,不断推拉注射器的目的是______。
②写出该实验中反应的化学方程式______。
③测得实验结果如下(气体体积):(单位:mL)
反应前玻璃管内 | 反应前注射器内 | 反应后注射器内 |
40 | 30 | 18 |
由此数据可以推算出他测定的空气中氧气的体积分数为______。
(实验结论)(1)研究空气的成分实验是在密封容器内进行。
(2)该物质在空气中可以燃烧且只与空气中的氧气反应。
(3)燃烧后的产物______。