题目内容
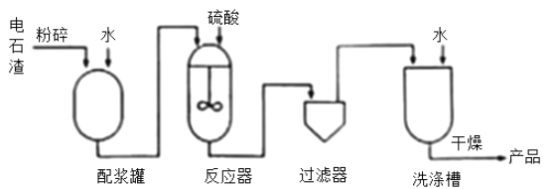
【题目】过氧化钙(CaO2)是用途广泛的优良供氧剂。以电石渣[主要成分为Ca(OH)2,含少量CaCO3]为原料制备过氧化钙的一种工艺流程如图所示。请按要求回答下列问题:
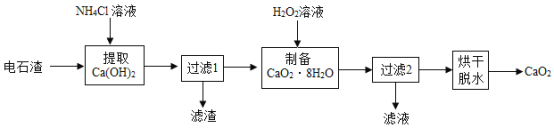
(查阅资料)
Ⅰ、Ca(OH)2+2NH4Cl=CaCl2+2NH3·H2O;
Ⅱ、CaCl2+2NH3·H2O+H2O2+6H2O=CaO2·8H2O↓+2NH4Cl;
Ⅲ、CaO2·8H2O在水中不稳定,会缓慢分解。
(1)Ca(OH)2的俗名为_____,“过滤1”所得滤渣的主要成分为_____,过氧化钙中氧元素的化合价为_____价。
(2)在实验室进行过滤操作时,要遵循“一贴、二低、三靠”原则。其中“一贴”指的是_____。生产过程中为了精确测定溶液的pH,常使用_____(填仪器名称)。
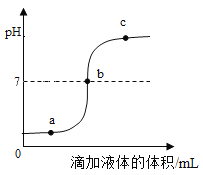
(3)在其他条件不变的情况下,制备CaO2·8H2O的反应时间(t)与产率(ω)的关系如图所示:
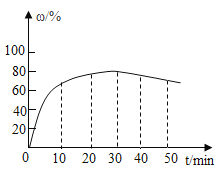
①平均反应速率最快的时间段为_____(填字母)。
a、0~10min
b、10~20min
c、20~30min
d、30~40min
②30min后,产率开始下降的主要原因是_____。
【答案】熟石灰 CaCO3 -1 滤纸紧贴漏斗内壁 pH计 a CaO2·8H2O在水中不稳定,会缓慢分解
【解析】
(1)氢氧化钙俗称为熟石灰;碳酸钙难溶于水,且不与氯化铵反应,因此滤渣为碳酸钙;过氧化钙中钙元素显+2价,设氧元素的化合价是![]() ,根据在化合物中正负化合价代数和为零,可知过氧化钙(CaO2)中氧元素的化合价:(+2)+2
,根据在化合物中正负化合价代数和为零,可知过氧化钙(CaO2)中氧元素的化合价:(+2)+2![]() =0,则
=0,则![]() =-1。
=-1。
(2)过滤时,为了保证过滤时滤液过滤效率,需要将滤纸紧贴漏斗内壁,避免产生气泡,影响过滤效率;测试溶液pH时,可以使用pH计测量溶液的pH,因此常用仪器为pH计;
(3)①平均反应速率最快的时间是出现在0-10min之间,故选a;
②30min后,产率开始下降的主要原因是:CaO2·8H2O在水中不稳定,会缓慢分解。

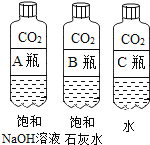
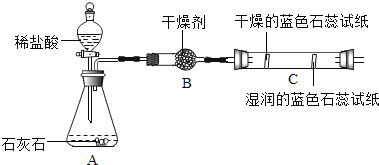
【题目】实验设计是化学实验的重要环节,下列实验用对比实验的方法探究二氧化碳的性质。请根据要求回答相关问题:
实验一 | 实验二 |
|
|
(1)实验一中振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生反应的化学方程式为___;对比A瓶与____ (填“B”或“C”)瓶的实验现象,可证明CO2能与NaOH发生反应。
(2)实验二观察到C装置中发生的现象是_____,结论是____(用化学方程式表示)。