题目内容
【题目】实验室中有一瓶部分变质了的NaOH溶液,小丽为了测定溶液中溶质的Na2CO3的质量分数,现取20g待测溶液,向其中逐滴加入CaCl2溶液,产生沉淀质量与所加CaCl2质量的关系如图所示。
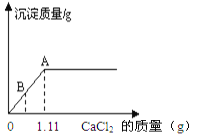
(1)B点处所得溶液中溶质有 。
(2)若加入的CaCl2溶液的质量分数为11.1%则需该溶液的质量为________
(3)求待测溶液中Na2CO3的质量分数。(写出计算过程)
【答案】(1)NaCl、Na2CO3、NaOH (2)10g (3)5.3%
【解析】
试题分析: (1)碳酸钠会与氯化钙反应生成碳酸钙沉淀和氯化钠,A点表示氯化钙与碳酸钠恰好完全反应,故B点表示的是碳酸钠还没有反应掉,故B点处所得溶液中有反应生成的氯化钠,没有变质的氢氧化钠和没有反应的碳酸钠三种;
(2)由图可知恰好完全反应时消耗的溶质氯化钙的质量为1.11g,
那么氯化钙溶液的质量=1.11g÷11.1%=10g
(3)利用化学方程式,根据碳酸钠与氯化钙反应的质量比即可计算出碳酸钠的质量。
设待测溶液中含Na2CO3的质量为X
Na2CO3 + CaCl2====== 2NaCl + CaCO3↓
106 111
X 1.11g
X=1.06g
Na2CO3质量分数=106×1.11g/20g×100%= 5.3%
答:待测溶液中Na2CO3的质量分数为5.3%

练习册系列答案
相关题目