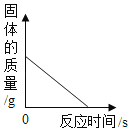
题目内容
【题目】金属钛(Ti)因具有许多神奇的性能而越来越引起人们的关注,被誉为“未来金属“。常温下钛不和非金属、强酸反应,加热至红热时,能与常见的非金属反应。工业上由钛铁矿(主要成分为FeTiO3)制取金属钛的主要工艺过程如图:
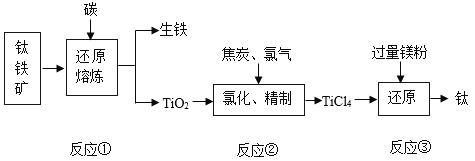
(1)反应前将钛酸亚铁和焦炭磨成粉末状的原因是_____。
(2)TiO2与C、Cl2在高温下反应,生成TiCl4和一种有毒气体,该气体是一种氧化物,其化学式为_____。
(3)写出步骤③中(Ar起保护气作用)在高温时生成金属钛的化学反应方程式_____,该反应的基本类型为_____。
(4)今年来,工业上用电解熔融的TiO2来制取金属钛获得成功,从能量的角度分析,工业利用该方法制备金属Ti的缺点是_____。
(5)如何从反应③后的固体中获得金属钛:_____。
【答案】为了增大反应物之间的接触面积,使反应更充分 CO TiCl4+2Mg![]() Ti+2MgCl2 置换反应 需要消耗大量的电能 向固体中加入足量盐酸(或稀硫酸),充分反应后过滤,洗涤,干燥
Ti+2MgCl2 置换反应 需要消耗大量的电能 向固体中加入足量盐酸(或稀硫酸),充分反应后过滤,洗涤,干燥
【解析】
四氯化钛和镁高温生成钛和氯化镁,二氧化钛和碳和氯气高温生成四氯化钛和一氧化碳,镁和稀盐酸反应生成氯化镁和氢气。
(1)反应前将钛酸亚铁和焦炭磨成粉末状的原因是为了增大反应物之间的接触面积,使反应更充分。
(2)TiO2与C、Cl2在高温下反应,生成TiCl4和一种有毒气体,该气体是一种氧化物,则氧化物是一氧化碳,故化学式为CO。
(3)步骤③中(Ar起保护气作用)在高温时生成金属钛的反应是四氯化钛和镁高温生成钛和氯化镁,反应的化学反应方程式为TiCl4+2Mg![]() Ti+2MgCl2,反应符合一种单质和一种化合物生成另一种单质和另一种化合物,故该反应的基本类型为置换反应。
Ti+2MgCl2,反应符合一种单质和一种化合物生成另一种单质和另一种化合物,故该反应的基本类型为置换反应。
(4)从能量的角度分析,工业利用该方法制备金属Ti的缺点是需要消耗大量的电能。
(5)常温下Ti不和非金属、强酸反应,所得产物Ti中混有过量Mg,则除去镁可利用稀盐酸![]() 或稀硫酸
或稀硫酸![]() ,镁能与盐酸
,镁能与盐酸![]() 或稀硫酸
或稀硫酸![]() 反应,则可将钛中的镁除去,充分反应后过滤,洗涤,干燥获得金属钛,故从反应③后的固体中获得金属钛的方法是向固体中加入足量盐酸(或稀硫酸),充分反应后过滤,洗涤,干燥。
反应,则可将钛中的镁除去,充分反应后过滤,洗涤,干燥获得金属钛,故从反应③后的固体中获得金属钛的方法是向固体中加入足量盐酸(或稀硫酸),充分反应后过滤,洗涤,干燥。

【题目】某化学兴趣小组的同学在做酸碱中和反应的实验时,向盛有氢氧化钙溶液的烧杯中加入一定量的稀盐酸后,忘了滴加酚酞溶液,不知道盐酸是否过量。于是他们停止滴加稀盐酸,对烧杯内溶液中的溶质成分进行了探究。
[提出问题]该烧杯内溶液中的溶质是什么?
[猜想与假设]猜想一:溶质只有CaCl2
猜想二:_________________________。
猜想三:溶质中含有CaCl2和Ca(OH)2;
猜想四:溶质中含有CaCl2、HCl和Ca(OH)2。
[交流讨论]同学们讨论后一致认为猜想四不合理,理由是__________(用化学方程式表示)。
[查阅资料]氯化钙溶液呈中性。
[实验设计]同学们设计了如下不同的实验方案,请完成下列表格。
方案 | 操作步骤 | 实验现象 | 实验结论 |
一 | 取少量烧杯内的溶液于试管中,滴入几滴无色酚酞溶液 | 酚酞不变色 | 猜想一正确 |
酚酞变红色 | 猜想三正确 | ||
二 | 取少量烧杯内的溶液于试管中,逐滴加入____________溶液至过量 | _____________ | 猜想二正确 |
[反思交流]方案一不能证明猜想一是否正确,理由是______________。若要完善此方案,可将酚酞溶液换成______________。
[拓展与应用]实验证明猜想二是正确的,要使烧杯内溶液的溶质只含有CaCl2,需要除去杂质,其中的一种方法是向烧杯中加入过量的__________,然后过滤。
[拓展延伸]在发生化学反应的过程中还伴随着温度的变化。室温下,将稀盐酸慢慢滴入装有氢氧化钙溶液的烧杯中,利用温度计测出烧杯中溶液的温度,溶液的温度随加入稀盐酸的质量而变化的曲线如图所示:
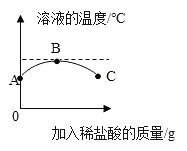
(1)由图可知,盐酸与氢氧化钙溶液发生的中和反应是_____________(填“吸热”“放热”或“无热量变化”)反应。
(2)向A点对应的溶液中加入紫色石蕊溶液,溶液呈_____________色。
(3)B点对应的溶液中的溶质是_______________(填化学式)。
(4)B到C的过程中溶液的pH逐渐________________(填“增大”“减小”或“无变化”)。