题目内容
根据粗盐提纯过程,回答:
(1)粗盐中含有较多的可溶性杂质(氯化镁、氯化钙)和不溶性杂质(泥沙等),可通过 、 、 等操作进行初步提纯。
(2)小江同学在粗盐提纯的实验过程中,经过两次过滤,滤液仍然浑浊,其原因可能是 、 或仪器不干净。
(1)溶解、过滤、蒸发
(2)倾倒液体时液面高于滤纸边缘 滤纸破损
解析试题分析:(1)过滤适用范围:用于分离难溶性固体与液体(或可溶性固体),可将粗盐中不溶性杂质(泥沙等)除去,要是溶质从溶液中结晶的两种方法 ①蒸发溶剂:适用于得到溶解度受温度影响较小的物质。如NaCl(海水晒盐)②降低温度(冷却热的饱和溶液):适用于得到溶解度随温度升高而升高的物质,如KNO3,所以粗盐提纯的步骤:溶解、过滤、蒸发
(2)在过滤操作中若一次过滤后滤液浑浊,需再次过滤,经过两次过滤,滤液仍然浑浊,那就要寻找原因,原因可能倾倒液体时液面高于滤纸边缘 、 滤纸破损、仪器不干净
考点:粗盐的提纯,过滤操作

下图装置可用来测定空气中氧气的含量。对该实验认识不正确的是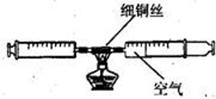
| A.铜丝的量不足会影响实验结论 |
| B.装置不漏气是实验成功的重要因素之一 |
| C.加热完后应立即观察体积变化,并记录实验数据 |
| D.实验中反复推拉针管可使反应物充分接触,使氧气完全反应 |
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容。
(1)“低碳生活”倡导低能量、低消耗,主要是为了减少 (填化学式)的排放量。
(2)如图为元素周期表中的一格,下列说法不正确的是 (填标号)。
| A.碳元素属于非金属元素 |
| B.碳原子核内质子数为6 |
C.碳元素的原子结构示意图为 |
| D.碳的相对原子质量为12.01 |

①该方案中观察到纸花的颜色变化是:
I.纸花变红Ⅱ.纸花不变红Ⅲ. Ⅳ. .
②步骤I、Ⅱ两项说明了什么? 。
③该同学设计以上四组实验是为了探究什么问题?
④写出该实验中所发生反应的化学方程式 .
(4)计算要使80g氧化铜完全还原,需要碳的质量至少是多少?
(9分)地球上的金属资源广泛地存在于地壳和海洋中,工业上主要是从含有金属元素并有开采价值的矿石中提炼金属。
(1)赤铁矿在自然界中储藏丰富,其主要成分的化学式是 。
(2)磁铁矿的主要成分是Fe3O4。在Fe3O4中存在两种不同价态的铁离子,其中1/3是Fe2+,2/3是Fe3+。请写出Fe3O4与盐酸反应的化学方程式 。
(3)工业上主要采用高炉炼铁,常用到的原料有铁矿石、焦碳、石灰石和空气。其中,焦碳的作用是 。(仅答一点)
(4)由于铁的氧化物中Fe3O4和FeO均为黑色,实验室用CO还原Fe2O3得到的铁中是否会含有Fe3O4和FeO,某同学设计了下列探究实验。
资料:FeCl3溶液与铁发生的反应是2FeCl3+Fe=3FeCl2,但FeCl3溶液不与Fe3O4、FeO反应;含有Fe3+的盐溶液遇到KSCN溶液时变成红色,利用该反应可检验Fe3+的存在。
【提出问题】CO还原Fe2O3得到黑色产物的成分是什么?
【猜 想】
猜想l:Fe 猜想2:Fe和Fe3O4;
猜想3:Fe和FeO; 猜想4: 。
【实验探究】限选试剂:C0、盐酸、澄清石灰水、KSCN溶液、FeCl3溶液。
| 实验操作 | 实验现象 | 实验结论 |
| Ⅰ取少量黑色产物加入到装有足量FeCl3溶液的烧杯中,充分反应后过滤,对过滤所得固体用蒸馏水洗涤。 | 黑色固体部分溶解。 | 猜想2和4都 不成立。 |
| Ⅱ , 。 | 黑色固体全部溶解,溶液 不变红色。 | |
| Ⅲ另取少量黑色产物装入玻璃管中,通入C0,一段时间后加热,并将反应后的气体通入装有一定量的 的烧杯中。 | 。 | 猜想l不成立, 猜想3成立。 |
下列化学实验能够成功的是
| A.小明用木炭代替红磷做测定空气中氧气含量的实验 |
| B.小颖用锌、铁、铜和稀盐酸确定锌、铁、铜三种金属的活动性 |
| C.小聪在20℃配制36%的氯化钠溶液(20℃时氯化钠的溶解度为36 g) |
| D.小青将过量的木炭粉和少量氧化铜粉的混合物置于蒸发皿里加强热,得到纯净的铜 |
下列依据实验目的进行的实验设计,合理的是( )
| 选项 | 实验目的 | 实验设计 |
| A | 从空气中获取纯净的氮气 | 用硫燃烧除去空气中的氧气 |
| B | 鉴别硬水和软水 | 观察颜色或闻气味 |
| C | 除去混在二氧化碳中的氯化氢气体 | 把混合气体通过足量的氢氧化钠溶液 |
| D | 鉴别硝酸铵和氯化钠固体 | 加适量的水溶解,测量前后温度变化 |
下列实验方案设计不合理的是
| A.用铅笔芯代替石墨试验导电性 | B.用燃着的木条区分二氧化碳和氮气 |
| C.用磁铁吸引来区分铁丝和铝丝 | D.用水区分氢氧化钠固体和硝酸铵固体 |

