题目内容
某实验小组为了除去铜丝网上的黑色物质(CuO),进行铜丝网的回收再利用,制定了如下两种方案。请根据方案回答:(提示:黑色铜丝网是铜和氧化铜混合物)
(1)甲方案的玻璃管中发生反应的化学方程式是 ,其中氧化铜失去氧,发生了 (填“氧化”或“还原”)反应。乙方案的烧杯中现象是 ,发生反应的化学方程式是_ 。两种方案相比较,甲方案明显的不足之处是 。
(2)若两种方案中加入的试剂均过量,则甲方案中回收的铜丝网的质量(填“<”、“>”、“=”) 乙方案中回收的铜丝网的质量。
(3)反应结束后,写出能证明乙方案中盐酸过量的实验操作和现象是 。
(4)若在乙方案反应后烧杯中的液体中加入足量的铁粉充分搅拌,最后得到的溶液中溶质为 。
(1)CuO+CO 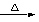 Cu+CO2 ;还原 ;固体溶解,溶液呈蓝色。CuO + 2HCl → CuCl2 + H2O ;没有尾气处理(或污染环境,合理给分)(2) > ;
Cu+CO2 ;还原 ;固体溶解,溶液呈蓝色。CuO + 2HCl → CuCl2 + H2O ;没有尾气处理(或污染环境,合理给分)(2) > ;
(3)取样于试管中,加入Fe(或Zn等活泼金属),产生气泡。
取样于试管中,加入碳酸钠(或碳酸盐),产生气泡。
取样于试管中,加入氧化铜(或氧化铁),固体溶解。
取样于试管中,加入氢氧化铜(或氢氧化铁),固体溶解。(合理即可)
(4)FeCl2(或氯化亚铁)
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
为了探究影响锌与盐酸反应剧烈程度的因素,某学习小组设计了下列实验。下列说法正确的是
| A.对比实验①和②,可研究盐酸的溶质质量分数对反应剧烈程度的影响 |
| B.对比实验②和③,可研究盐酸的溶质质量分数对反应剧烈程度的影响 |
| C.对比实验②和③,可研究温度对反应剧烈程度的影响 |
| D.对比实验①和②,可研究温度对反应剧烈程度的影响 |
实验小组用如下的装置进行实验。
| 实 验 步 骤 | 简 答 |
| 第一步:称取3g氯酸钾与少量二氧化锰混合后放入装置①的试管中,点燃酒精灯。 | 装置①的试管中发生反应的文字表达式: |
| 第二步:加热试管一段时间后,用橡皮管连接a、b。 | 刚开始加热时,排出的气体不宜立即收集,原因是 。 |
| 第三步:当装置②中水面不再下降,断开a、b,移去酒精灯,将装置②中的集气瓶密封,并贴上标签备用。 | |
| 第四步:读取量筒里水的体积数并记录。 | 读数时,视线必须与液体凹液面的 保持水平。 |
下列实验方案中,设计合理的是
| A.用点燃的方法除去CO2中少量的CO |
| B.加入氧化镁除去硫酸镁溶液中含有的少量硫酸(氧化镁难溶于水) |
| C.用活性炭将硬水软化 |
| D.用水除去生石灰中混有的碳酸钙 |



