题目内容
【题目】现甲、乙两化学小组安装两套如下相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素。

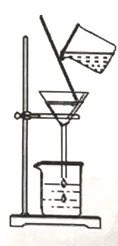
(1)开始时,将如图装置连接好,关闭分液漏斗活塞,将装置置于80℃的水中,看见注射器活塞微微向外移动,说明_______________________________________。
(2)甲小组有如下实验设计方案,完成下表。
实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
甲组实验Ⅰ | 探究___________对 H2O2分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2%H2O2溶液 |
甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2溶液 |
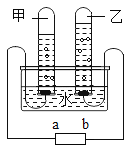
(3)甲、乙两小组得出如图数据。

①甲组实验得出的数据可知浓度越大,H2O2分解速率 ___________
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析,相同条件下H2O2在________(填“酸”或“碱”)性环境下放出气体速率较快。
(4)在查阅资料时,同学们得知氧化铁也可以作为过氧化氢分解制取氧气的催化剂,那么,氧化铁和二氧化锰这两种物质哪一种对过氧化氢分解的催化效果更好呢?
①在探究前,他们在控制变量的问题上提出了不同的观点,你认为不正确的是(_______________)
A.过氧化氢溶液的浓度一定相同 B.催化剂的质量一定相同
C.反应前过氧化氢溶液的温度一定相同 D.反应容器的容积一定相同
②请设计实验,比较氧化铁和二氧化锰对过氧化氢分解的催化效果,写出实验方案______________。
【答案】装置气密性良好 过氧化氢浓度 越快 碱 D 取相同体积和浓度的过氧化氢溶液于两支试管中,分别加入等质量的二氧化锰和氧化铁,比较两支试管产生气泡的速率
【解析】
(1)开始时,将如图装置连接好,关闭分液漏斗活塞,将装置置于80℃的水中,看见注射器活塞微微向外移动,说明装置气密性良好。
故填:装置气密性良好。
(2)两个实验不同的地方时过氧化氢的浓度,故探究的是过氧化氢浓度对反应速率的影响。
故填:过氧化氢浓度。
(3)①甲组实验得出的数据可知浓度越大,H2O2分解速率越快;
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析相同条件下H2O2在碱性环境下放出气体速率较快。
故填:越快;碱。
(4)①探究二氧化锰、氧化铁对过氧化氢分解速率的影响时,他们在控制变量的问题上提出了不同的观点,我认为不正确的是:反应容器的容积一定相同;故填:D;
②取相同体积和浓度的过氧化氢溶液于两支试管中,分别加入等质量的二氧化锰和氧化铁,比较两支试管产生气泡的速率,得出结论即可。故填:取相同体积和浓度的过氧化氢溶液于两支试管中,分别加入等质量的二氧化锰和氧化铁,比较两支试管产生气泡的速率。

【题目】(探究活动一)为探究催化剂的种类对氯酸钾分解速率的影响,甲同学设计如表对比实验:
氯酸钾的质量 | 催化剂的种类 | 催化剂 的质量 | 反应条件 | 收集45.0mLO2所需的时间(s) | |
Ⅰ | 3.0g | MnO2 | 1.0g | 混合加热 | 21 |
Ⅱ | xg | CuO | 1.0g | 混合加热 | 48 |
(1)表Ⅱ中x的值应为___________;通过分析上表数据,可以得出的实验结论是:在相同的条件下,KClO3在MnO2作催化剂比CuO作催化剂的分解速率_______ (选填“快”或“慢”);写出氯酸钾、二氧化锰加热反应的文字表达式________。
(探究活动二)为探究过氧化氢浓度对过氧化氢分解速率的影响,乙同学设计以下实验:
[进行实验]
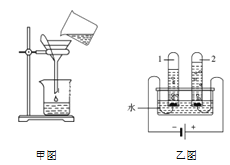
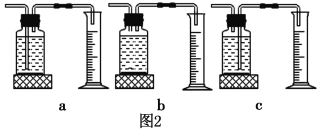
室温下,选用50.0g不同溶质质量分数的过氧化氢溶液(1%、2%和4%)分别与0.1g二氧化锰进行实验(如图1,固定夹持仪器略去)。
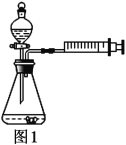
(2)MnO2在H2O2分解前后其质量和__________没有发生改变,试写出H2O2分解反应的文字表达式________。
[数据处理]
(3)乙同学进行实验后,获得的相关实验数据记录如表所示:
过氧化氢溶液的质量 | 过氧化氢的浓度 | MnO2的质量 | 温度 | 相同时间(10s)内产生O2体积(mL) | |
Ⅰ | 1% | 0.1g | 20℃ | 9 | |
Ⅱ | 50.0g | 2% | 0.1g | 20℃ | 16 |
Ⅲ | 50.0g | 4% | 0.1g | 20℃ | 31 |
①本实验中,测量O2体积的装置也可以选用如图2的哪套装置来代替_________(填编号)。
②分析上表数据,可以得出不同浓度的过氧化氢对过氧化氢分解速率影响的结论是:_________
【题目】在研究“酸碱中和反应”时,某兴趣小组同学想证明稀盐酸与氢氧化钠溶液混合后是否发生了化学反应,进行了如下探究:
(1)在盛有氢氧化钠溶液的烧杯中滴人几滴酚酞试液,再逐滴加入稀盐酸,并不断搅拌(如图一)。用数字化传感器测得盐酸与氢氧化钠溶液混合前后的温度变化情况(如图二)。
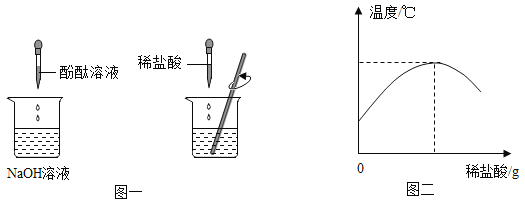
图一实验中滴加稀盐酸后发生的现象为__________________;由实验现象和曲线变化情况分析可知,盐酸和氢氧化钠溶液发生了反应并________(填“吸收”或“放出”)热量。
(2)从微观角度分析盐酸与氢氧化钠溶液的反应如图描述了该反应的微观实质,图中A、B、C处应填入的化学符号依次是____________。

(3)同学们讨论后认为,如果用检验盐酸和氢氧化钠减少(或消失)、或者有新物质生成,都能证明反应已经发生。继续探究实验后烧杯中溶质的成分,来证明反应的发生。
步骤 | 现象 | 结论 |
实验1:取烧杯中的溶液少许于试管中,加入硫酸铜溶液 | ____________________________ | 证明没有 |
实验2:另取烧杯中的溶液少许于试管中,加入硝酸银溶液 | 出现白色沉淀 | 证明含有 |
实验3:再取烧杯中的溶液少许于蒸发皿中,加热蒸干 | 有___________产生 | 证明有 |
(得出结论)氢氧化钠溶液和盐酸发生了中和反应。
(评价反思)有同学认为,仅通过实验2得出“溶液中含有![]() ”证据不足,理由是___________________。
”证据不足,理由是___________________。