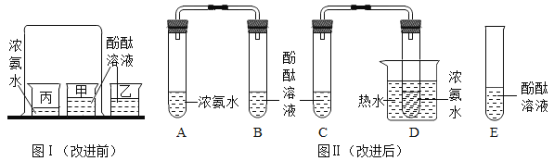
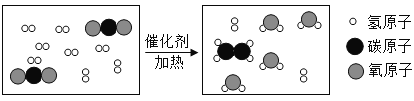
题目内容
【题目】如图是电解水制氢的简易装置图。回答下列问题:
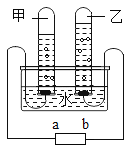
(1)甲管生成的气体为_____,b 端接电源_____极;
(2)理论上甲、乙两试管中气体的体积比为_____;
(3)水中加入少量氢氧化钠的目的是_____;
(4)通过以上实验得出的结论:水是由_____组成的;
(5)该实验过程可用化学反应方程式表示为_____。
【答案】氢气 正 2:1 增强水的导电性 氢元素和氧元素 ![]()
【解析】
(1)水电解时,正极产生氧气,负极产生氢气,体积比为1:2。由电解水制氢的简易装置图可知,甲管生成的气体较多是氢气,乙试管收集的气体较少是氧气,b端接电源正极;
(2)理论上甲、乙两试管中气体的体积比为2:1;
(3)由于氢氧化钠在水中能解离出自由移动的离子,所以水中加入少量氢氧化钠的目的是:增强水的导电性;
(4)通过以上电解水实验生成了氢气和氧气,氢气是由氢元素组成,氧气是由氧元素组成,化学变化中元素的种类不变,所以水是由氢元素和氧元素组成的;
(5)电解水生成了氢气和氧气,反应化学方程式是:![]() 。
。

 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】现甲、乙两化学小组安装两套如下相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素。

(1)开始时,将如图装置连接好,关闭分液漏斗活塞,将装置置于80℃的水中,看见注射器活塞微微向外移动,说明_______________________________________。
(2)甲小组有如下实验设计方案,完成下表。
实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
甲组实验Ⅰ | 探究___________对 H2O2分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2%H2O2溶液 |
甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2溶液 |
(3)甲、乙两小组得出如图数据。

①甲组实验得出的数据可知浓度越大,H2O2分解速率 ___________
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析,相同条件下H2O2在________(填“酸”或“碱”)性环境下放出气体速率较快。
(4)在查阅资料时,同学们得知氧化铁也可以作为过氧化氢分解制取氧气的催化剂,那么,氧化铁和二氧化锰这两种物质哪一种对过氧化氢分解的催化效果更好呢?
①在探究前,他们在控制变量的问题上提出了不同的观点,你认为不正确的是(_______________)
A.过氧化氢溶液的浓度一定相同 B.催化剂的质量一定相同
C.反应前过氧化氢溶液的温度一定相同 D.反应容器的容积一定相同
②请设计实验,比较氧化铁和二氧化锰对过氧化氢分解的催化效果,写出实验方案______________。