题目内容
【题目】通过一年的化学学习,相信你已经掌握了一些化学知识与实验探究能力。
Ⅰ.请结合下列实验装置图回答问题。

(1)写出图中①的仪器名称:_______。
(2)实验室用加热高锰酸钾的方法制取氧气,反应的化学方程式为_____________。
(3)查阅资料发现,氧化铜可以用作过氧化氢分解制氧气的催化剂。现有一根洁净的铜丝,实验前先将其绕成螺旋状,再经过加热处理。改进后的发生装置如图G所示(已略去夹持装置)。
①铜丝绕成螺旋状的作用是_________。
A.收集到更多的氧气 B.加快反应速率 C.没有影响
②与装置A比较,改进后装置的优点是_______。
(4)实验室常用锌粒和稀硫酸反应制取氢气,应选用的发生装置为______(填字母)。
Ⅱ.过氧化钠(Na2O2)是淡黄色固体,保存不当会变质而发白色。化学兴趣小组查得以下资料,对于过氧化钠变质的原理,有两种不同的原因:
甲:2Na2O2 + 2CO2 ═ 2Na2CO3 + O2
乙:2Na2O2 + 2H2O ═ 4NaOH + O2↑
为探究过氧化钠变质原理的合理性,开展以下实验。
【实验过程】
[实验1]取适量保存不当而变质发白色的固体于试管中,加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊。
(1)石灰水变浑浊的原因是_____________________(用化学方程式表示)。
(2)化学兴趣小组认为:据此现象,还不能得出“反应甲是造成过氧化钠变质的原因”的结论。理由是_____。
[实验2]兴趣小组设计了如下图的实验装置,探究二氧化碳与过氧化钠反应。B中盛有饱和碳酸氢钠溶液,可除去二氧化碳中混有的氯化氢气体。

(3)C中盛有浓硫酸,其作用是______________________________________。
(4)在D中观察到_______________现象时,说明二氧化碳与过氧化钠发生了化学反应。
[实验2] 兴趣小组按下图所示装置探究水和过氧化钠反应。

(5)检验有氧气生成的方法是_______________________。
(6)根据酚酞试液变红色,可以检验有_____________生成,实验过程中观察到溶液变红,后红色褪去。(老师提示: 过氧化钠与水反应生成了一种不很稳定、具有漂白性的H202使酚酞由红色褪为无色。)
[实验3]水和过氧化钠反应产物的再探究
(7)另取水与过氧化钠反应后的无色溶液于烧杯中,加入二氧化锰,目的是___________,充分搅拌后,再滴加无色酚酞试液,溶液变成红色且放置一段时间都不褪色。由此得出反应乙也是过氧化钠变质的原因。
【反思提高】过氧化钠与二氧化碳和水都会发生化学反应而变质,最终都生成碳酸钠,因此过氧化钠必须______保存。
【答案】 锥形瓶 2KMnO4![]() K2MnO4+MnO2+O2↑ B 可以控制反应的进行与停止 A Ca(OH)2 + CO2 = CaCO3↓+ H2O 无法判断Na2CO3是按反应甲原理产生的,还是按反应乙生成的NaOH与空气中的二氧化碳反应而产生的(或其它合理答案) 吸收二氧化碳气体中的水蒸气 淡黄色固体变白色 将带火星的木条放在导管中a处,观察木条复燃。 氢氧化钠(或NaOH 促进过氧化氢分解 密封
K2MnO4+MnO2+O2↑ B 可以控制反应的进行与停止 A Ca(OH)2 + CO2 = CaCO3↓+ H2O 无法判断Na2CO3是按反应甲原理产生的,还是按反应乙生成的NaOH与空气中的二氧化碳反应而产生的(或其它合理答案) 吸收二氧化碳气体中的水蒸气 淡黄色固体变白色 将带火星的木条放在导管中a处,观察木条复燃。 氢氧化钠(或NaOH 促进过氧化氢分解 密封
【解析】Ⅰ:(1)图中①的仪器名称是锥形瓶;(2)加热高锰酸钾的方法制取氧气,反应的化学方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑;(3)①将铜丝绕成螺旋状,增大了与反应物的接触面积,加快了反应的速率;②改进后的装置,通过抽动铜丝来控制反应的发生和停止;(4)实验室常用锌粒和稀硫酸制取氢气,由于反应的固体和液体且反应不需加热,故发生装置可选A;Ⅱ:(1)变质生成的碳酸钠与硫酸反应生成二氧化碳使澄清石灰水变浑浊,反应的化学方程式为:Ca(OH)2+CO2=CaCO3+H2O;(2)乙中生成的氢氧化钠会跟空气中二氧化碳反应生成生成碳酸钠,加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊,因此无法判断Na2CO3是按反应甲原理产生的,还是按反应乙生成的NaOH与空气中的二氧化碳反应而产生的;(3) C中盛有浓硫酸,其作用是吸收二氧化碳气体中的水蒸气;(4)过氧化钠(Na2O2)是淡黄色固体,保存不当会变质而发白色;(5)检验有氧气生成的方法是:将带火星的木条放在导管中a处,观察木条复燃;(6)据2Na2O2+2H2O═4NaOH+O2↑可知:酚酞试液变红色,说明有氢氧化钠生成;(7)过氧化钠与水反应生成了一种不很稳定、具有漂白性的H202,所以加入二氧化锰可以促进过氧化氢分解;【反思提高】过氧化钠与二氧化碳和水都会发生化学反应而变质,最终都生成碳酸钠,因此过氧化钠必须密封保存。
K2MnO4+MnO2+O2↑;(3)①将铜丝绕成螺旋状,增大了与反应物的接触面积,加快了反应的速率;②改进后的装置,通过抽动铜丝来控制反应的发生和停止;(4)实验室常用锌粒和稀硫酸制取氢气,由于反应的固体和液体且反应不需加热,故发生装置可选A;Ⅱ:(1)变质生成的碳酸钠与硫酸反应生成二氧化碳使澄清石灰水变浑浊,反应的化学方程式为:Ca(OH)2+CO2=CaCO3+H2O;(2)乙中生成的氢氧化钠会跟空气中二氧化碳反应生成生成碳酸钠,加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊,因此无法判断Na2CO3是按反应甲原理产生的,还是按反应乙生成的NaOH与空气中的二氧化碳反应而产生的;(3) C中盛有浓硫酸,其作用是吸收二氧化碳气体中的水蒸气;(4)过氧化钠(Na2O2)是淡黄色固体,保存不当会变质而发白色;(5)检验有氧气生成的方法是:将带火星的木条放在导管中a处,观察木条复燃;(6)据2Na2O2+2H2O═4NaOH+O2↑可知:酚酞试液变红色,说明有氢氧化钠生成;(7)过氧化钠与水反应生成了一种不很稳定、具有漂白性的H202,所以加入二氧化锰可以促进过氧化氢分解;【反思提高】过氧化钠与二氧化碳和水都会发生化学反应而变质,最终都生成碳酸钠,因此过氧化钠必须密封保存。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案【题目】梅老师带领的化学兴趣小组在学习资料卡片“石笋和钟乳石的形成”时,发现难溶于水的CaCO3当遇到溶有CO2的水时,会发生反应:CaCO3+CO2+H2O= Ca(HCO3)2,反应生成的Ca(HCO3)2溶解性较大。联想到实验室检验CO2时,将气体通入澄清石灰水中能生成CaCO3。若长时间往澄清石灰水中通入CO2会产生什么样的现象呢?如果长时间向碱溶液中通入二氧化碳又会如何反应?小章和小丽决定用小烧杯盛装一定量的氢氧化钠溶液并不断通入二氧化碳气体进行探究。
【提出问题】
氢氧化钠溶液中通入二氧化碳一段时间后,溶液中会有什么溶质?
【查阅资料】
(1)通入少量的二氧化碳时,NaOH与CO2能反应的化学方程式_____________。
(2)通入过量的二氧化碳时,反应的化学方程式为Na2CO3+CO2+H2O= 2NaHCO3
(3)碳酸氢盐都能溶于水
(4)Na2CO3、NaHCO3的溶液呈碱性、BaCl2呈中性
【提出猜想】
(1)溶质有NaOH、Na2CO3; (2)溶质为Na2CO3;
(3)溶质是___________________(填化学式); (4)溶质全部是NaHCO3
【设计实验方案】
实验步骤 | 实验现象 | 实验结论 |
①用试管取少量小烧杯中反应后的溶液,滴加几滴________试液(填酸碱指示剂) | 溶液变红色 | 该溶液显碱性 |
②将小烧杯中反应后剩下的溶液进行称量,然后滴加过量的BaCl2溶液 | 有_________生成 | 猜想(4)不成立 |
③取步骤②静置后的上层清液, 滴入稀盐酸 | 有气泡冒出 | 猜想(1)和(2)不成立 |
【得出结论】猜想(3)成立
【讨论交流】
(1)小王同学提出实验步骤①是多余的。你认为该实验设计_______________(填“需要”或“不需要”),理由______________________。
(2)将实验步骤②剩下混合物进行过滤、洗涤、干燥、称量。发现所得沉淀质量等于步骤②中所称量的溶液质量的十分之一,试计算氢氧化钠溶液中通入二氧化碳一段时间后,溶液中Na2CO3的质量分数为__________________。(写出计算过程,最后结果保留小数点后两位)
(3)验证二氧化碳性质时,如果长时间向澄清石灰水中通入二氧化碳会看到什么样的现象呢?请你描述一下:_____________________。
【知识拓展】
梅老师引导同学们再次研读教材,发现遇热或压强变小时,Ca(HCO3)2又能反应生成CaCO3,并告诉同学们,干粉灭火器中用NaHCO3灭火的原理与之类似,请写出该反应方程式_______,在生活中,NaHCO3还有许多用处,请说出一种____________。
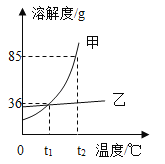
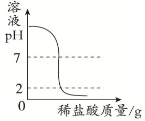
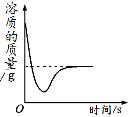
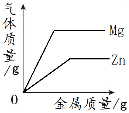
【题目】下列四个图像中,能正确反映对应变化关系的是
|
|
|
|
A.向一定量的氢氧化钠溶液中逐滴加入pH = 2的稀盐酸至过量 | B.某温度时,向一定量的饱和石灰水中加入少量生石灰 | C.向两份完全相同的稀盐酸中分别加入锌粉、镁粉 | D.将水通电一段时间 |