题目内容
【题目】碳酸钠在生产和生活中有着广泛的用途。某校化学兴趣小组的同学们为了学习碳酸钠的化学性质,开展了如下探究活动。
[设计与实验]
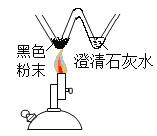
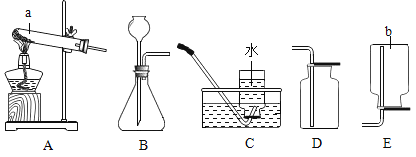
同学们分别取适量的碳酸钠溶液于4支
试管中,完成如下图所示的实验。
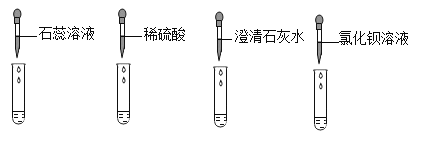
(1)实验一中,同学们观察到溶液变为蓝色。
(2)实验二中,当小婧观察到不再产生气泡时,溶液中存在的阴离子是_______(填化学符号)。
(3)实验三中,反应的化学方程式为________。
(4)实验四中,小辉看到有白色沉淀产生,该化学反应的基本类型是______。
[得出结论]
根据以上实验,兴趣小组的同学们得出了碳酸钠的化学性质,即:碳酸钠能与______反应、能与酸反应、能与某些碱反应、能与某些______反应。
[反思与提高]
(1)小亮在完成实验三时没有看到明显的实验现象,可能的原因是______。
(2)小明发现草木灰的主要成分碳酸钾在组成上与碳酸钠有相似之处,于是对草木灰的主要成分进行了检验,其实验操作、现象和结论是______。草木灰是一种常用的钾肥,对农作物的生长所起的作用是______,不能与_______混合施用。
【答案】![]()
![]() 复分解反应 指示剂(填写具体物质不得分) 盐(填写具体物质不得分) 石灰水变质(或碳钠溶液变质) 取样品少许于试管中,滴加稀盐酸,若有气泡产生,证明草木灰的主要成分是碳酸钾(或取样品加水溶解,向上层清液中滴加澄清的石灰水,有白色沉淀生成,证明草木灰的主要成分是碳酸钾)(答案合理即得分) 增强抗病虫害能力(或抗倒伏能力) 铵态氮肥(或铵盐)(填写具体物质也可得分)。
复分解反应 指示剂(填写具体物质不得分) 盐(填写具体物质不得分) 石灰水变质(或碳钠溶液变质) 取样品少许于试管中,滴加稀盐酸,若有气泡产生,证明草木灰的主要成分是碳酸钾(或取样品加水溶解,向上层清液中滴加澄清的石灰水,有白色沉淀生成,证明草木灰的主要成分是碳酸钾)(答案合理即得分) 增强抗病虫害能力(或抗倒伏能力) 铵态氮肥(或铵盐)(填写具体物质也可得分)。
【解析】
稀硫酸和碳酸钠反应生成硫酸钠和水和二氧化碳,碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,氯化钡和碳酸钠反应生成碳酸钡沉淀和氯化钠。
(2) 实验二中发生的反应为稀硫酸和碳酸钠反应生成硫酸钠和水和二氧化碳,故当小婧观察到不再产生气泡时,说明碳酸钠反应完全,溶液中存在的阴离子是![]() 。
。
(3)实验三中发生的反应为碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,反应的化学方程式为![]() 。
。
(4)实验四中发生的反应为氯化钡和碳酸钠反应生成碳酸钡沉淀和氯化钠,小辉看到有白色沉淀产生,化学反应的基本类型是复分解反应。
[得出结论]
碳酸钠能与指示剂反应、能与酸反应、能与某些碱反应、能与某些盐反应。
[反思与提高]
(1) 实验三中发生的反应为碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,则小亮在完成实验三时没有看到明显的实验现象,可能的原因是石灰水变质(或碳酸钠溶液变质)。
(2) 小明发现草木灰的主要成分碳酸钾在组成上与碳酸钠有相似之处,实验如下:取样品少许于试管中,滴加稀盐酸,若有气泡产生,证明草木灰的主要成分是碳酸钾(或取样品加水溶解,向上层清液中滴加澄清的石灰水,有白色沉淀生成,证明草木灰的主要成分是碳酸钾)。草木灰是一种常用的钾肥,对农作物的生长所起的作用是增强抗病虫害能力(或抗倒伏能力),草木灰和铵态氮肥(或铵盐)混合施用会生成氨气,降低肥效,故不能与铵态氮肥(或铵盐)混合施用。

【题目】学习了二氧化锰对过氧化氢有催化作用的知识后。某同学想:氧化铜能否起到类似二氧化锰的催化剂作用呢?于是进行了如下探究。
(猜想)Ⅰ.氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ.氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
Ⅲ.氧化铜是反应的催化剂,反应前后_____和_____不变。
(实验)用天平称量0.2g氧化铜,取5mL 5%的过氧化氢溶液于试管中,进行如下实验:
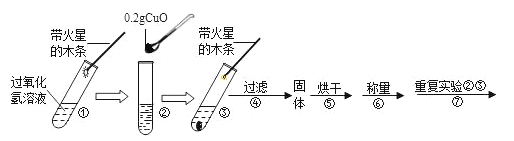
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
_____, 带火星的木条复燃 | 所得固体 _____g | 溶液中有气泡放出, _____ | 猜想Ⅰ、Ⅱ不成立 猜想Ⅲ成立 |
(2)步骤①的目的是_____。
(3)过氧化氢能被氧化铜催化分解放出氧气的化学反应的文字表达式为_____。
【题目】某化工厂用废硫酸制备![]() 的流程如下:
的流程如下:
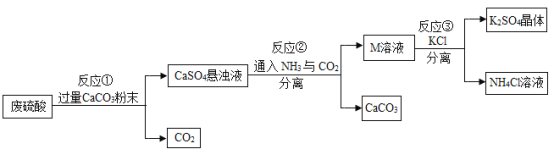
(1)生产上将CaCO3研成粉末的目的是________,欲达此目的,还可采用的方法是________。(任写一条)
(2)上述流程中,可循环使用的物质是________________。(填化学式)
(3)写出反应①中主要的化学方程式________________。
(4)反应③中相关物质的溶解度如下表所示,反应③在常温下可实现的原因是____________。
物质 | KCl | K2SO4 | NH4Cl | (NH4)2SO4 |
溶解度/g(20℃) | 34.2 | 11.1 | 37.2 | 75.4 |
(5)洗涤反应③所得晶体最适宜的试剂是________(填序号)
A H2O B 饱和K2SO4溶液 C 二者均可
(6)检验K2SO4晶体是否洗涤干净的方法是______________。