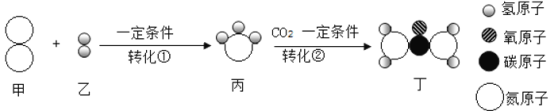
题目内容
【题目】某物质![]() 完全燃烧后生成
完全燃烧后生成![]() 和
和![]() 。对该物质的判断正确的是
。对该物质的判断正确的是
A.该物质由碳、氢、氧元素组成
B.该物质只含有碳、氢两种元素
C.该物质中氧元素的质量分数为![]()
D.该物质的分子中碳原子和氢原子的个数比为![]()
【答案】A
【解析】
8.8g二氧化碳中碳元素的质量为8.8g×![]() ×100%=2.4g;
×100%=2.4g;
3.6g水中氢元素的质量为3.6g×![]() ×100%=0.4g,其中碳元素和氢元素全部来自于某物质中,氢元素和碳元素的质量之和为2.4g+0.4g=2.8g<4.4g,所以物质中一定含有氧元素,且氧元素的质量为4.4g-2.8g=1.6g。
×100%=0.4g,其中碳元素和氢元素全部来自于某物质中,氢元素和碳元素的质量之和为2.4g+0.4g=2.8g<4.4g,所以物质中一定含有氧元素,且氧元素的质量为4.4g-2.8g=1.6g。
A、根据上述分子可知A选项正确;
B、根据上述分子可知B选项错误;
C、该物质中氧元素的质量分数为![]() ×100%≈36.3%;
×100%≈36.3%;
D、该物质的分子中碳原子和氢原子的个数比为![]() :
:![]() =1:2,故错误。
=1:2,故错误。
故选A。

【题目】下表是几种可燃物在常压时的沸点;
可燃物 | CH4 | C2H6 | C3H8 | X | C5H12 |
沸点/℃ | 164 | 88.6 | 42.1 | 0.5 | 36.1 |
(1)在C3H8中,碳元素与氢元素的质量比为_____________(最简整数比)。
(2)在C3H8中,碳元素的质量分数为_____________(计算结果精确至0.1%)。
(3)45gC2H6与_____________gC5H12所含碳元素质量相等。
(4)分析上表中可燃物分子结构上的规律,推测X的化学式为_____________。
【题目】据央视报道,有不法酒类生产企业在白酒中添加酯类物质以增强口感。下表中是机中常见的酯。
酯的名称 | 甲酸甲酯 | 甲酸乙酯 | 乙酸甲酯 | 乙酸乙酯 |
化学式 | C2H4O2 | C3H8O2 | C2H8O2 | X |
(1)比较归纳是学习化学的重要方法,上述物质的共同特点是______(写出一条即可)。
(2)甲酸甲酯(C2H4O2)中碳、氢、氧的原子个数为______。
(3)据表推测X的化学式为______。
(4)请计算乙酸甲酯(C2H8O2)中碳、氢、氧三种元素的质量之比______。
(5)试计算甲酸甲酯中碳元素的质量分数______
【题目】酸、碱、盐在生产、生活中具有广泛的用途。
(1)化学实验室有失去标签的稀硫酸、氢氧化钠、酚酞、碳酸钠、硝酸钡等五瓶无色溶液,现将其任意编号:![]() ,然后两两组合进行实验,其部分现象如下表:
,然后两两组合进行实验,其部分现象如下表:
实验 |
|
|
|
|
现象 | 产生气体 | 产生沉淀 | 产生沉淀 | 溶液变红 |
①写出溶液![]() 中溶质的化学式:
中溶质的化学式:![]() _____,
_____,![]() _____。
_____。
②写出溶液![]() 与
与![]() 反应的化学方程式_____。
反应的化学方程式_____。
(2)将氯化钠和氯化钙的混合物![]() 溶于水,再加入
溶于水,再加入![]() 溶质质量分数为
溶质质量分数为![]() 的碳酸钠溶液,恰好完全反应,则该混合物中氯元素的质量分数为_____(结果精确到
的碳酸钠溶液,恰好完全反应,则该混合物中氯元素的质量分数为_____(结果精确到![]() )。
)。