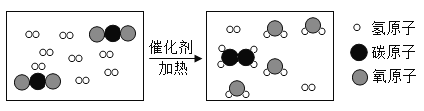
题目内容
【题目】某化工厂用废硫酸制备![]() 的流程如下:
的流程如下:
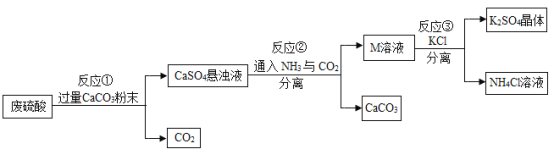
(1)生产上将CaCO3研成粉末的目的是________,欲达此目的,还可采用的方法是________。(任写一条)
(2)上述流程中,可循环使用的物质是________________。(填化学式)
(3)写出反应①中主要的化学方程式________________。
(4)反应③中相关物质的溶解度如下表所示,反应③在常温下可实现的原因是____________。
物质 | KCl | K2SO4 | NH4Cl | (NH4)2SO4 |
溶解度/g(20℃) | 34.2 | 11.1 | 37.2 | 75.4 |
(5)洗涤反应③所得晶体最适宜的试剂是________(填序号)
A H2O B 饱和K2SO4溶液 C 二者均可
(6)检验K2SO4晶体是否洗涤干净的方法是______________。
【答案】加快反应速率 加热 CaCO3 H2SO4+CaCO3=CaSO4+H2O+CO2↑ 常温下K2SO4的溶解度小 B 取最后一次洗涤液,先加入过量的Ba(NO3)2溶液,振荡、静置,目的是除去硫酸根,再向上层清液中滴加AgNO3溶液,如果没有白色沉淀,说明洗涤干净。
【解析】
(1)增大反应物的接触面积和升温可以加快反应速率,所以生产上将CaCO3研成粉末的目的是加快反应速率,欲达此目的,还可采用的方法是加热;
(2)观察上述流程,发现二氧化碳和碳酸钙既是反应物也是生成物,所以可循环使用的物质有CO2和CaCO3;
(3)碳酸钙和硫酸反应生成硫酸钙、水和二氧化碳,化学方程式为:H2SO4+CaCO3=CaSO4+H2O+CO2↑;
(4)由复分解反应发生的条件可知,反应Ⅲ中虽没有不溶物,但常温下K2SO4的溶解度小,在生成物中会以沉淀的形式出现,所以反应可以进行;
(5)用饱和K2SO4溶液洗涤反应Ⅲ所得晶体可以减少K2SO4的溶解;
(6)为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入过量的Ba(NO3)2溶液,振荡、静置,目的是除去硫酸根,再向上层清液中滴加AgNO3溶液,如果没有白色沉淀,说明洗涤干净。

【题目】据央视报道,有不法酒类生产企业在白酒中添加酯类物质以增强口感。下表中是机中常见的酯。
酯的名称 | 甲酸甲酯 | 甲酸乙酯 | 乙酸甲酯 | 乙酸乙酯 |
化学式 | C2H4O2 | C3H8O2 | C2H8O2 | X |
(1)比较归纳是学习化学的重要方法,上述物质的共同特点是______(写出一条即可)。
(2)甲酸甲酯(C2H4O2)中碳、氢、氧的原子个数为______。
(3)据表推测X的化学式为______。
(4)请计算乙酸甲酯(C2H8O2)中碳、氢、氧三种元素的质量之比______。
(5)试计算甲酸甲酯中碳元素的质量分数______