题目内容
【题目】有一包粉末,已知由BaSO4、FeCl3、Ba(NO3)2、Na2SO4、NaOH、NaCl中的几种组成。为了确定其成分,现进行以下实验,各步骤均已充分反应。
步骤一:取一定质量的粉末,加水搅拌后过滤,得到有色沉淀甲和无色溶液A;
步骤二:向步骤一的沉淀甲中加入足量稀盐酸,固体全部消失并得到黄色溶液;
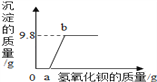
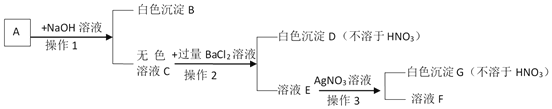
步骤三:将步骤一得到的无色溶液A进行如下图所示的实验。
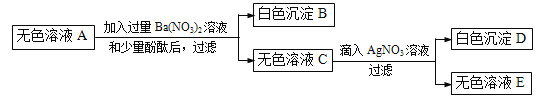
则下列说法中正确的是:
A. 原白色粉末中一定有FeCl3、Na2SO4、NaOH、Ba(NO3)2
B. 有色沉淀甲可能是Fe(OH)3和BaSO4 的混合物
C. 若将步骤二中的盐酸换成硝酸,则可确定原白色粉末是否含有NaCl
D. 原白色粉末中FeCl3和NaOH的质量比为65:48
【答案】D
【解析】硫酸钡难溶于水,氯化铁在溶液中显黄色,氯化铁和氢氧化钠会生成氯化钠和红褐色的氢氧化铁沉淀,硝酸钡和硫酸钠会生成不溶于酸的硫酸钡沉淀,氢氧化铁与稀盐酸反应会生成氯化铁的黄色溶液,取一定质量的粉末,加水搅拌后过滤,得到有色沉淀甲和无色溶液A,向步骤一的沉淀甲中加入足量稀盐酸,固体全部消失并得到黄色溶液,所以粉末中一定含有氢氧化钠和氯化铁,一定不含硫酸钡,将步骤一得到的无色溶液A中加入硝酸钡,生成白色沉淀,所以粉末中一定含有硫酸钠,一定不含硝酸钡,无色溶液C中加入硝酸银,会生成白色沉淀,氯化铁中含有氯离子,所以粉末中可能含有氯化钠,所以:A、向步骤一的沉淀甲中加入足量稀盐酸,固体全部消失,因此没有硫酸钡,原有氯化钠是否存在对本题的现象没有明显的影响,所以这包粉末中一定含有物质的化学式是:FeCl3、Na2SO4、NaOH,故A错误;B、根据“向步骤一的沉淀甲中加入足量稀盐酸,固体全部消失并得到黄色溶液”,“固体全部消失”,说明沉淀中含有氢氧化铁,而不含有BaSO4,故B错误;C、若将步骤二中的盐酸换成硝酸,也不能确定原白色粉末是否含有NaCl,因为这包粉末中一定含有的氯化铁会引入氯离子,故C错误;
D、FeCl3+3NaOH═Fe(OH)3↓+3NaCl
162.5 120
由化学方程式可知,参加反应的FeCl3和NaOH的质量比是65:48,所以粉末中的FeCl3和NaOH的质量比为65:48,故D正确。故选D。

【题目】下列事实解释不正确的是()
选项 | 事实 | 解释 |
A | NaOH 和 |
|
B | 金刚石、石墨高温下都可以燃烧 | 它们都是有碳原子构成的 |
C | 给装满水的纸杯加热,开始时纸杯完好无损 | 温度没有达到纸的着火点 |
D | 酒精灯不用时,需用灯帽盖好 | 防止酒精挥发到空气中 |
A. A B. B C. C D. D