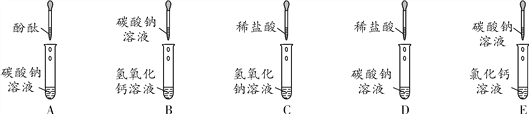
题目内容
【题目】我国每年报废的手机超过1亿部,废旧手机的电路板中含有铝、铁、铜、银、金等多种金属。下图是某工厂回收其中部分金属的流程图,请你回答:
(已知:2Cu+O2+2H2SO4 ==2CuSO4+2H2O;不考虑金、银发生类似反应)
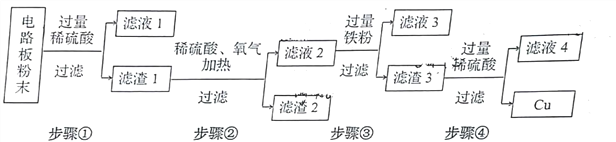
(1)将电路板粉碎成粉末的目的是___________
(2)滤液1中的溶质除硫酸外还有___________(填写化学式,下同);滤渣2中含有___________
(3)请你写出步骤③发生反应的化学方程式: ___________
【答案】 增大与稀硫酸的接触面积,使反应充分进行 Al2(SO4)3和FeSO4 Ag和Au Fe+ CuSO4=FeSO4 +Cu
【解析】本题考查了金属的化学性质。
(1)将电路板粉碎成粉末的目的是增大与稀硫酸的接触面积,使反应充分进行;
(2) 在铝、铁、铜、银、金中能与硫酸反应的是铝和铁,分别生成Al2(SO4)3、FeSO4。滤液1中的溶质除硫酸外还有Al2(SO4)3和FeSO4;滤渣1含有铜、银、金,根据题中提供信息,在流程中铜与硫酸和氧气在加热时生成可溶性的硫酸铜,金、银发生没有发生类似的反应,滤渣2中含有Ag和Au;
(3)步骤③发生的反应是铁与硫酸铜反应生成硫酸亚铁和铜,化学方程式是Fe+ CuSO4=FeSO4 +Cu。

【题目】兴趣小组同学对“氢氧化钠溶液与稀硫酸混合是否发生了化学反应”进行了如下探究:
【提出问题】氢氧化钠溶液与稀硫酸混合是否发生了化学反应?
【猜想与假设】
a:二者混合发生了化学反应;
b:二者混合没有发生化学反应。
【设计并实验】
实验操作 | 实验现象 | |
甲同学 | 向盛有10mL一定溶质质量分数的氢氧化钠溶液的烧杯中,用胶头滴管慢慢滴入1-2滴稀硫酸,振荡,同时测定溶液的pH | 溶液pH减小但仍大于7 |
乙同学 | 向盛有10mL一定溶质质量分数的氢氧化钠溶液的烧杯中,先滴入几滴无色酚酞试液,然后再加入稀硫酸 | 溶液由红色变为无色 |
【得出结论】氢氧化钠溶液与稀硫酸发生了化学反应。
(1)乙同学认为甲的实验设计不合理,原因是_____________,改进的方法是____________;根据改进后的实验现象说明二者混合后发生了化学反应,写出氢氧化钠溶液与稀硫酸反应的化学方程式__________;甲同学也认为乙的实验设计也不合理,你是否赞同,说出你的理由___________。
【思考与交流】
丙同学在绝热装置中,向分别盛有10mL10%氢氧化钠溶液加入不同体积某浓度的稀硫酸,充分混合后溶液的温度变化曲线如图(混合前稀硫酸和氢氧化钠溶液均为18℃)。
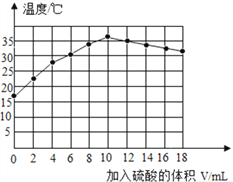
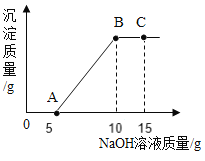
(2)根据图示分析,稀硫酸和氢氧化钠的反应是__________(填吸热、放热)反应,加入稀硫酸_________mL时,二者恰好完全反应.
【题目】NH4C1和Na2SO4的溶解度表及溶解度曲线如下。下列说法错误的是
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度 S/g | NH4C1 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
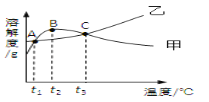
A. t2应介于30℃ ~50℃
B. 10℃ 时,饱和的Na2SO4溶液的溶质质量分数为9.6%
C. 甲、乙饱和溶液从t3降温到t2,溶质的质量分数都变小
D. B点、C点对应的甲的溶液,溶质质量分数大小关系为B>C