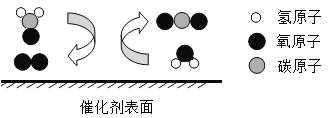
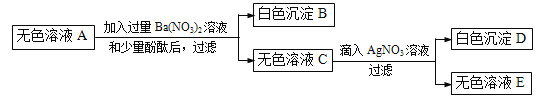
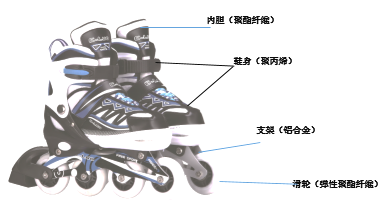
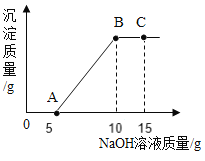
题目内容
【题目】鸡蛋壳的主要成分是碳酸钙,为了测定某鸡蛋壳中碳酸钙的质量分数,某同学进行了如下实验,讲鸡蛋壳洗净、干燥并捣碎后,称取10 g放在烧杯里,然后往烧杯里加入足量的稀盐酸90g,充分反映以后,称的剩余物为96.48g,请计算:(假设其他物质不与盐酸反应)
(1)生成二氧化碳的质量________.
(2)该鸡蛋壳中碳酸钙的质量分数_________.
【答案】 3.52g 80%
【解析】解:(1)生成的二氧化碳质量为:10g+90g-96.48g=3.52g;
(2)设该鸡蛋壳中碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 3.52g
![]()
x=8g,
该鸡蛋壳中碳酸钙的质量分数=![]() ×100%=80%,
×100%=80%,
答:生成的二氧化碳质量为3.52g,该鸡蛋壳中碳酸钙的质量分数为80%。

练习册系列答案
相关题目