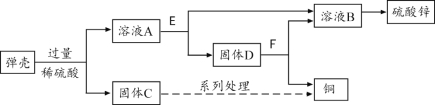
题目内容
【题目】(7分)金属及金属材料在生产、生活中应用广泛。
(1)铜可以拉成铜丝,这是利用金属的_________。
(2)铝具有很好的抗腐蚀性能,原因是 (用化学方程式表示)。
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如图所示),纯铜片上留下明显的划痕,该实验说明了 。

(4)写出高炉炼铁中CO还原氧化铁的化学反应方程式 。
(5)铜器在潮湿的空气中也容易生锈,铜锈(俗称铜绿)的主要成分是Cu2(OH)2CO3,结合其组成分析,铜生锈是铜与水、 和 共同作用的结果。
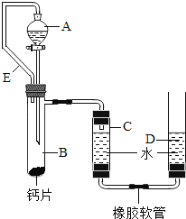
(6)新型材料纳米级Fe粉能用作高效催化剂。实验室采用还原法制备纳米级Fe粉,其流程如下图所示(通入N2的目的是防止生成的纳米级铁粉被氧化):

写出Ⅱ中H2还原FeCl2置换出铁的化学方程式 。
【答案】(1)延展性
(2)4Al + 3O2===2Al2O3
(3)黄铜的硬度比纯铜的大
(4)Fe 2O3 + 3CO![]() 2Fe + 3CO2
2Fe + 3CO2
(5)O2 、CO2
(6)H2+FeCl2![]() Fe + 2HCl
Fe + 2HCl
【解析】
试题分析:(1)铜可以拉成铜丝,这是利用金属的延展性;
(2)铝具有很好的抗腐蚀性能,原因是铝易与空气中的氧气反应生成一层致密的氧化铝薄膜,能阻止铝的进一步氧化:4Al + 3O2===2Al2O3;
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如右图所示),纯铜片上留下明显的划痕,该实验说明了黄铜的硬度比纯铜的大;
(4)一氧化碳还原氧化铁生成的是铁和二氧化碳:Fe 2O3 + 3CO![]() 2Fe + 3CO2;
2Fe + 3CO2;
(5)依据质量守恒定律化学反应前后元素的种类不变,那么可知铜生锈是铜与水、氧气和二氧化碳共同作用的结果;
(6)依据质量守恒定律化学反应前后元素的种类不变,H2还原FeCl2置换出铁的同时还生成了盐酸:
H2+FeCl2![]() Fe + 2HCl 。
Fe + 2HCl 。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案