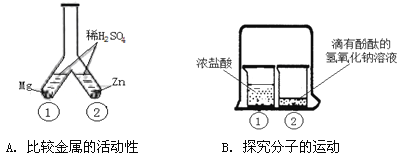
题目内容
【题目】(2分)含锌30%的黄铜用作弹壳的制造。现有一批使用过的、锈迹斑斑的弹壳,处理这些弹壳可以制得铜和硫酸锌,其主要过程如下图所示。
提示:弹壳上的锈主要为Cu2(OH)2CO3,能与稀硫酸反应得到硫酸铜溶液;弹壳中其他杂质不溶于水、不参加反应。
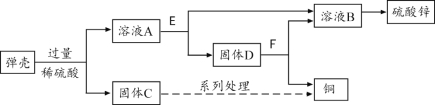
(1)固体D为 。
(2)溶液A中加入E后发生反应的化学方程式为 。
【答案】(1)Zn 和Cu
(2)Zn + H2SO4 === ZnSO4 + H2↑、Zn + CuSO4 === ZnSO4 + Cu
【解析】
试题分析:弹壳的主要成分是铜锌合金,表面还有铜锈,根据信息,Cu2(OH)2CO3能与稀硫酸反应得到硫酸铜溶液,锌也能与硫酸反应得到硫酸锌和氢气,氢气会逸散到空气中,铜不能与硫酸反应。通过过滤可得到铜和滤液硫酸锌和硫酸铜;由于该实验要得到的是铜和硫酸锌,而实验中加入的硫酸是过量的,故要向溶液A中加入过量的金属锌,锌与硫酸反应生成硫酸锌和氢气,锌还会把硫酸铜中的铜置换出来;通过过滤,又可分离得到铜、锌和硫酸锌溶液,铜中的锌可加入适量的硫酸除去。

练习册系列答案
相关题目