题目内容
【题目】(8分)某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
(1)为探究催化剂的种类对氯酸钾分解速度的影响,甲设计以下对比实验:
Ⅰ.将3.0 g KClO3与1.0 g MnO2均匀混合加热。
Ⅱ.将x g KClO3与1.0 g CuO均匀混合加热。
在相同温度下,比较两组实验产生O2的快慢。
Ⅰ中反应的化学方程式是 ;Ⅱ中x的值应为________。
(2)乙探究了影响双氧水分解速度的某种因素。反应的化学方程式为 ,有关实验数据记录如下:
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2质量 | |
Ⅰ | 50.0 g | 1% | 0.1 g | 0.013 mg |
Ⅱ | 50.0 g | 2% | 0.1 g | 0.023 mg |
Ⅲ | 50.0 g | 4% | 0.1 g | 0.044 mg |
本实验中,测量O2质量应用了图的装置。根据实验装置实验所依据的原理是 。
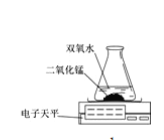
实验结论:在相同条件下,________,双氧水分解得越快。
【答案】(1)2KClO3![]() 2KCl + 3O2 ↑ 3.0g
2KCl + 3O2 ↑ 3.0g
(2)2H2O2![]() 2H2O+ O2 ↑ 锥形瓶与反应物减少的质量即生成氧气的质量 反应物的浓度越大
2H2O+ O2 ↑ 锥形瓶与反应物减少的质量即生成氧气的质量 反应物的浓度越大
【解析】
试题分析:(1)Ⅰ中反应的化学方程式是2KClO3![]() 2KCl + 3O2 ↑ ;甲设计的实验是对比实验,需要运用控制变量法,则Ⅱ中x的值也应为3g;
2KCl + 3O2 ↑ ;甲设计的实验是对比实验,需要运用控制变量法,则Ⅱ中x的值也应为3g;
(2)乙探究过程所发生反应的化学方程式为:2H2O2![]() 2H2O+ O2 ↑;根据实验装置实验所依据的原理是依据锥形瓶与反应物减少的质量即生成氧气的质量;实验结论:在相同条件下,反应物的浓度越大双氧水分解得越快。
2H2O+ O2 ↑;根据实验装置实验所依据的原理是依据锥形瓶与反应物减少的质量即生成氧气的质量;实验结论:在相同条件下,反应物的浓度越大双氧水分解得越快。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目