题目内容
【题目】(6分)为测定一瓶氢氧化钠溶液的质量分数,小张同学进行了以下实验:
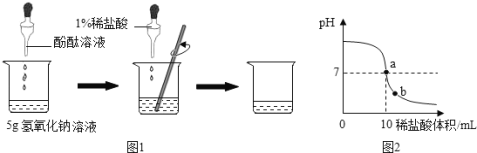
如图1所示,在烧杯中加入5g氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入1% 的稀盐酸,并不断搅拌,至溶液颜色恰好变为无色为止。
请回答:
(1)酚酞溶液的作用是 。
(2)当溶液颜色恰好变为无色时,共用去稀盐酸7.3g,则该氢氧化钠溶液中溶质的质量分数为 。
(3)在以上实验操作中,如继续滴加1%稀盐酸,并不断搅拌,则整个实验过程中溶液pH的变化曲线如图2所示。
①a点表示的含义是 ;
②b点溶液中含有的阳离子有 (填离子符号)。
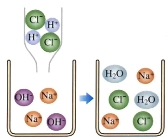
(4)下图是盐酸滴入氢氧化钠溶液中有关粒子之间反应的示意图。由此可看出,盐酸与氢氧化钠能发生反应的原因是 。
【答案】(1)判断氢氧化钠与盐酸恰好完全反应
(2)1.6 %
(3)①恰好中和 (或溶液呈中性, 或溶液的pH=7) ②Na+、H+
(4)氢氧化钠溶液中的氢氧根离子与盐酸中的氢离子反应生成水分子(或有水生成)
【解析】
试题分析:(1)酚酞试液是指示剂,碱能使酚酞试液变红,酸和中性溶液不能使酚酞试液变色,故酚酞溶液的作用是判断氢氧化钠与盐酸恰好完全反应;
(2)当溶液颜色恰好变为无色时,说明氢氧化钠与盐酸恰好完全反应,那么利用化学方程式根据氢氧化钠与盐酸反应的质量比即可计算出氢氧化钠溶液中溶质的质量。7.3g稀盐酸中溶质的质量
=7.3g×1%=0.073g
设氢氧化钠中溶质的质量为x,
HCl + NaOH == NaCl + H2O
36.5 40
0.073g x
36.5/0.073g =40/x
X=0.08g
该氢氧化钠溶液中溶质的质量分数=0.08g/5g ×100%=1.6%
(3)a点溶液的PH=7,说明氢氧化钠溶液与盐酸恰好完全反应,溶液呈中性;b点的PH<7,说明溶液呈酸性,则是盐酸过量,此时溶液中含有氯化钠和盐酸,含有的阳离子有Na+、H+;
(4)氯化钠与盐酸发生的是中和反应,中和反应的实质是酸中的氢离子和碱中的氢氧根离子结合生成水的过程。