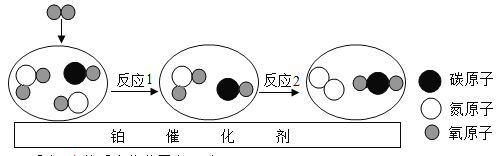
题目内容
【题目】科技推动着奥林匹克运动的发展,在奥运会中化学的表现十分突出。

(1)“鸟巢”的建造中使用了大量的钢铁。生产这些钢铁时要在高温条件下将Fe2O3用一氧化碳还原成铁,其反应的化学方程式为_____。
(2)“水立方”的膜结构是由化学合成材料ETFT制成的,化学式是(C2H2F2)n ,则其相对分子质量的计算式是_____。
(3)撑杆跳高使用的玻璃纤维杆,其主要成分是SiO2、Al2O3等,在物质分类中它们属于__(填序号)。
A.单质 B.化合物 C.氧化物
(4)采集奥林匹克圣火的唯一方式,是在奥林匹克的赫拉神庙前通过太阳光集中在凹面镜的中央,引燃圣火。此过程中最关键的燃烧条件是______________。
(5)奥运会需要大量的能量。物质发生化学反应的同时,伴随着能量的变化,通常表现为____的变化。太阳能、___、___潮汐能等新能源的广泛开发利用还有待于研究。
【答案】Fe2O3+3CO![]() 2Fe+3CO2 (12×2 + 1×2 +19×2) ×n B C 温度达到可燃物的着火点 热量 核能或风能或地热能等
2Fe+3CO2 (12×2 + 1×2 +19×2) ×n B C 温度达到可燃物的着火点 热量 核能或风能或地热能等
【解析】
(1)由题意可知反应物、反应条件、生成物,故写出CO与Fe2O3在高温条件下反应的化学方程式:Fe2O3+3CO![]() 2Fe+3CO2;(2)化学式是(C2H2F2)n的ETFT相对分子质量的计算式是:(12×2+1×2+19×2)×n;(3)二氧化硅、氧化铝都是由氧元素和另外一种元素组成的化合物,属于氧化物;(4)燃料与空气中的氧气充分接触,引燃圣火的关键是凹面镜聚集的热量能否达到燃料的着火点;(5)物质发生化学反应的同时,伴随着能量的变化,通常表现为热量的变化。人类通过化学反应获得的能量大多来自于化石燃料,但还要努力开发太阳能、核能(或风能或地热能等)、潮汐能等新能源。
2Fe+3CO2;(2)化学式是(C2H2F2)n的ETFT相对分子质量的计算式是:(12×2+1×2+19×2)×n;(3)二氧化硅、氧化铝都是由氧元素和另外一种元素组成的化合物,属于氧化物;(4)燃料与空气中的氧气充分接触,引燃圣火的关键是凹面镜聚集的热量能否达到燃料的着火点;(5)物质发生化学反应的同时,伴随着能量的变化,通常表现为热量的变化。人类通过化学反应获得的能量大多来自于化石燃料,但还要努力开发太阳能、核能(或风能或地热能等)、潮汐能等新能源。

【题目】有一种石灰石样品的成分是CaCO3和SiO2(已知SiO2既不溶于水也不与盐酸反应)。课外小组为了测定该石灰石样品中碳酸钙的质量分数,将一定量的石灰石样品放入烧杯中,再将100 g稀盐酸分4次加入烧杯中,每次均充分反应。实验数据记录如下:
次数 | 第一次 | 第二次 | 第三次 | 第四次 |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
反应后烧杯中物质的总质量/g | 35.2 | 58.4 | 82.6 | 107.6 |
(1)第1次加入稀盐酸充分反应后,生成二氧化碳的质量。
(2)该石灰石样品中碳酸钙的质量。