题目内容
【题目】某校化学兴趣小组的同学根据实验室提供的仪器和药品,在老师的指导下从下图中选择装置进行了几种气体的制备实验。

(1)写出仪器a的名称:___________。
(2)甲同学选择装置BE制氧气。选用E装置收集氧气的原因是________,若改用F装置收集氧气,氧气从导管_______(填“b”或“c”)进入。用分液漏斗相比较长颈漏斗的优点是________,实验结束后,若将MnO2分离开来的操作是__________,用B装置还用于实验室制取CO2,该反应的化学方程式是_________。
(3)乙同学实验发现,只用KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快。KClO3的分解速率大大加快的原因是________。
实验反思:通过以上实验探究,你对催化剂的认识是______。
A.MnO2只能作过氧化氢溶液分解的催化剂
B.催化剂在反应前后质量和性质都不变
C.催化剂能加快化学反应的速率,不影响生成物的量
D.用作催化剂的物质可能是其他反应的反应物或生成物
【答案】锥形瓶 氧气不易溶于水 b 可控制反应速率 过滤 CaCO3+2HCl=CaCl2+H2O+CO2↑ 因为高锰酸钾分解也会产生氧气,同时产生的二氧化锰对氯酸钾的分解起催化作用 CD
【解析】
(1)标号仪器是锥形瓶;(2) 选用E装置收集氧气的原因是:氧气可用排水法收集是因为氧气不易溶于水,氧气密度比空气大,所以应从长管进气,即从导管b进入;分液漏斗相比较长颈漏斗而言,可控制液体的滴加速度,进而可控制反应速率;B装置属于固液常温型,说明是用过氧化氢制取氧气,反应生成水,二氧化锰是反应的催化剂,其质量在反应前后不变,而二氧化锰不溶于水,所以实验结束后,若将MnO2分离开来,可进行过滤的操作;实验室制取二氧化碳用大理石和稀盐酸常温反应,也可用此装置,反应的符号表达式是:CaCO3+2HCl=CaCl2+CO2↑+H2O;(3)如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快,KMnO4在KClO3的分解反应中不是作催化剂,原因是加了高锰酸钾之后,产生氧气速度加快是因为高锰酸钾分解也会产生氧气,同时产生的二氧化锰对氯酸钾的分解起催化作用;
实验反思:A、MnO2还可以作为氯酸钾分解的催化剂,错误;B、催化剂在反应前后质量和化学性质都不变,错误;C、催化剂是改变反应速率,对生成物的质量多少没有影响,正确;D、二氧化锰可以催化过氧化氢分解,也是高锰酸钾分解的生成物,正确。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
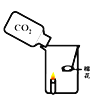
小学生10分钟应用题系列答案【题目】在今年五校“庆元旦 贺新年”联欢晚会上,戴校长给同学们表演了一个魔术:大烧杯中盛有一只燃着的蜡烛和一团包有过氧化钠(Na2O2)的棉花,将一瓶二氧化碳倒入烧杯中,蜡烛慢慢的熄灭,然后棉花突然剧烈的燃烧起来。这出乎意料的现象引起了同学们的极大兴趣,请你参与同学们的讨论和探究。
蜡烛熄灭的原因是___________________________。
(提出问题)棉花为什么会燃烧?
(提出猜想)
(1)可能是蜡烛燃烧引燃了棉花。
(2)可能是二氧化碳与过氧化钠反应生成了氧气。
(3)______________________________________。
(实验验证)
序号 | 实验操作 | 主要实验现象 | 实验结论及解释 |
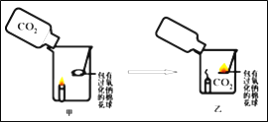
① | 按下图装置进行实验
| 蜡烛慢慢熄灭 | 猜想﹙1﹚___ ﹙填成立或不成立﹚ |
② | 向盛满二氧化碳的氧气瓶中进入适量的过氧化钠粉末,成分震荡,并______ | _________ | 二氧化碳与过氧化钠反应生成了氧气猜想﹙2﹚成立 |
③ | _____________ | _________ | 猜想﹙3﹚成立 |
(实验结论)
(1)CO2 与Na2O2反应生成了氧气与一种化合物,化学方程式为_________________。
(2)通常CO2可作灭火剂,但有些物质(如Na2O2)着火,不能用CO2熄灭。