题目内容
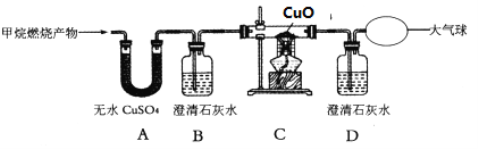
【题目】小明设计了如下图所示的实验装置,进行CO还原CuO的实验.试回答:
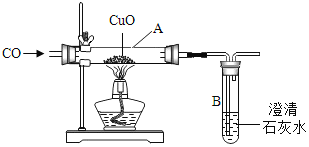
﹙1)该装置存在一处不完善的地方是 ______ ;解决的方法是 ______ 。
(2)实验开始时,先要进行的操作是 ______ ;为什么 ______ 。(选填序号:①加热②通CO)
(3)实验过程中A和B处的实验现象分别是 _________ , _________ ,A处的化学反应化学方程式______ ; B处反应的化学方程式是 ______ 。
(4)实验结束后,先熄灭酒精灯,再停止通一氧化碳,其原因是____________ 。
【答案】缺尾气处理装置 点燃除去或收集 ② 排尽空气防止发生爆炸 黑色固体变红 变浑浊 CO+CuO=Cu+CO2 CO2+Ca(OH)2=CaCO3↓+H2O 防止铜被氧化
【解析】
(1)一氧化碳有毒,应该有尾气处理装置,而本题无尾气处理装置,所以该实验的问题是无尾气处理装置;因为一氧化碳可以燃烧生成对大气无污染的二氧化碳气体,所以可以用燃烧的方法把一氧化碳处理掉或收集;
(2)若不先通一氧化碳气体,则该装置中混有空气,不纯的CO加热有爆炸的危险,所以在加热之前要先通一会儿一氧化碳;
(3)黑色的氧化铜在高温条件下可以被一氧化碳还原为红色的铜,化学反应式是:CuO+CO![]() Cu+CO2 ;同时产生二氧化碳气体,澄清石灰水变浑浊,化学反应式是: CO2+Ca(OH)2=CaCO3↓+H2O;
Cu+CO2 ;同时产生二氧化碳气体,澄清石灰水变浑浊,化学反应式是: CO2+Ca(OH)2=CaCO3↓+H2O;
(4)如果实验结束后,先停止通一氧化碳,在温度较高时铜能和氧气反应生成氧化铜。

 名校课堂系列答案
名校课堂系列答案【题目】在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如表所示,下列说法不正确的是( )
物质 | X | Y | Z | W |
反应前质量/g | 10 | 3 | 90 | 0 |
反应后质量/g | 3.2 | 3 | 待测 | 3.2 |
A. W可能是单质 B. Y可能是催化剂
C. 该反应是分解反应 D. 反应后Z物质的质量为![]()
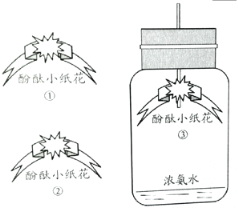
【题目】在今年五校“庆元旦 贺新年”联欢晚会上,戴校长给同学们表演了一个魔术:大烧杯中盛有一只燃着的蜡烛和一团包有过氧化钠(Na2O2)的棉花,将一瓶二氧化碳倒入烧杯中,蜡烛慢慢的熄灭,然后棉花突然剧烈的燃烧起来。这出乎意料的现象引起了同学们的极大兴趣,请你参与同学们的讨论和探究。
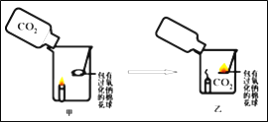
蜡烛熄灭的原因是___________________________。
(提出问题)棉花为什么会燃烧?
(提出猜想)
(1)可能是蜡烛燃烧引燃了棉花。
(2)可能是二氧化碳与过氧化钠反应生成了氧气。
(3)______________________________________。
(实验验证)
序号 | 实验操作 | 主要实验现象 | 实验结论及解释 |
① | 按下图装置进行实验
| 蜡烛慢慢熄灭 | 猜想﹙1﹚___ ﹙填成立或不成立﹚ |
② | 向盛满二氧化碳的氧气瓶中进入适量的过氧化钠粉末,成分震荡,并______ | _________ | 二氧化碳与过氧化钠反应生成了氧气猜想﹙2﹚成立 |
③ | _____________ | _________ | 猜想﹙3﹚成立 |
(实验结论)
(1)CO2 与Na2O2反应生成了氧气与一种化合物,化学方程式为_________________。
(2)通常CO2可作灭火剂,但有些物质(如Na2O2)着火,不能用CO2熄灭。
【题目】化学兴趣小组为了测定一批石灰石样品中碳酸钙的质量分数,取用20g石灰石样品,把80g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余成分既不与盐酸反应,也不溶解于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如右表:
稀盐酸的用量 | 剩余固体的质量 |
第一次加入20g | 15g |
第二次加入20g | 10g |
第三次加入20g | 5g |
第四次加入20g | 3g |
(1)石灰石样品中碳酸钙的质量分数为_________;
(2)第一次实验参加反应的碳酸钙的质量为__________g;
(3)计算第一次加入20g稀盐酸充分反应后生成二氧化碳的质量为_________。(写出计算过程)