题目内容
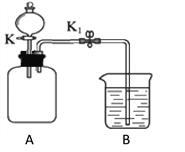
【题目】小金为了探究温度对H2O2分解反应速率的影响,借助如图所示实验装置(夹持装置略去),进行了两次实验,两次实验的部分设计如表所示:

(1)写出实验中发生的化学反应的化学式表达式:_____________,二氧化锰在反应中的作用是__________。取用二氧化锰可以用________(填“药匙”或“镊子”)。
(2)MnO2中锰元素的化合价为___________;
(3)实验2中应加入5%H2O2_____________毫升;
(4)在两次实验中,可通过_______________来比较H2O2分解反应速率的大小;
(5)实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有______________;
(6)实验结束后若要将MnO2从混合物中分离回收,可采取的方法是_____________。该方法用到的玻璃仪器有玻璃棒、___________、____________。玻璃棒的作用是______,将本实验中的二氧化锰经分离、干燥后称量,其质量为________g。
【答案】H2O2 ![]() H2O+O2 催化作用(或催化) 药匙(或纸槽) +4 40 注射器活塞向右滑动的速率 80℃比20℃时产生的水蒸气多 过滤 漏斗 烧杯 引流 0.5
H2O+O2 催化作用(或催化) 药匙(或纸槽) +4 40 注射器活塞向右滑动的速率 80℃比20℃时产生的水蒸气多 过滤 漏斗 烧杯 引流 0.5
【解析】
本题主要考查了过氧化氢制氧气中温度对H2O2分解反应速率的影响,混合物的分离提纯等,难度不大,综合性较强。
(1)过氧化氢在二氧化锰催化作用下反应生成水和氧气,发生的化学反应的化学式表达式:H2O2 ![]() H2O+O2,二氧化锰在反应中的作用是催化作用(或催化)。二氧化锰是粉状固体,取用二氧化锰可以用药匙(或纸槽);
H2O+O2,二氧化锰在反应中的作用是催化作用(或催化)。二氧化锰是粉状固体,取用二氧化锰可以用药匙(或纸槽);
(2)二氧化锰中氧元素的化合价为-2价,设MnO2中锰元素的化合价x,则x+(-2)×2=0,x =+4;
(3) 利用对比试验探究温度对H2O2分解反应速率的影响时,变量应是温度,其余的量应相同,所以,实验2中应加入5%H2O240毫升;
(4) 在两次实验中,可通过相同的时间内注射器内气体的体积多少 来比较H2O2分解反应速率的大小,即注射器活塞向右滑动的速率来比较H2O2分解反应速率的大小;
(5)实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有温度较高时水蒸发成水蒸气;
(6)实验结束后若要将MnO2从混合物中分离出来,由于MnO2不溶于水,可采取的方法是过滤;该方法用到的玻璃仪器有玻璃棒、漏斗、 烧杯;玻璃棒的作用是引流;二氧化锰在实验中用作催化剂,在反应前后质量不变,将本实验中的二氧化锰经分离、干燥后称量,其质量为0.5g。

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案【题目】观察是学习化学的重要方法
(1)小明要证明蜡烛中含有碳和氢元素,如图1完成实验,请你填写实验报告。
实验步骤 | 实验现象 | 实验结论 |
1.取一个干冷烧杯,罩在蜡烛火焰的上方,观察。 | 烧杯内的有水雾,感觉烧杯发烫 | 蜡烛燃烧后生成______, 证明蜡烛中含有_____元素。 |
2.取一个内壁蘸有澄清石灰水的烧杯,罩在蜡烛火焰上方,观察。 | __________________ | 蜡烛燃烧后生成_________, 证明蜡烛中含有______元素。 |
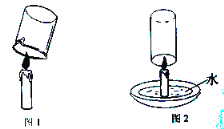
(2)小德用玻璃杯迅速扣住燃着的蜡烛,并使杯口始终浸没在水中,下列说法正确的是_______(填序号)
A.可观察到蜡烛最终熄灭
B.最终杯内液面高于碗中液面
C.该方法能准确测定空气中氧气的含量
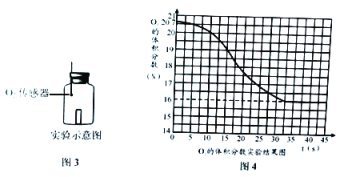
(3)如图3,小茵利用O2传感器在密闭容器内测定蜡烛燃烧过程中O2的体积分数,观察图4的实验结果,可知初始时O2的体积分数是_____________%,蜡烛熄灭时O2的体积分数是_____________%。相同实验条件下,小茵另取一瓶混有空气的O2进行测定,初始时O2的体积分数是30%,蜡烛熄灭时O2的体积分数跟前次实验一样,你猜想原因是_______________________________________。