题目内容
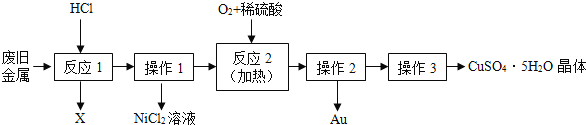
【题目】木炭粉还原氧化铜实验后的混合粉末中含有铜、氧化铜、少量木炭粉,实验室从该混合粉末中回收铜的方案如下。
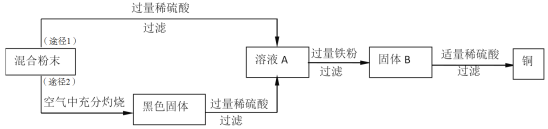
请根据流程图,回答下列问题:
(1)稀硫酸的溶质是H2SO4,其中硫元素的化合价为_________。
(2)固体B所含的物质是________(填物质化学式),溶液A加入过量铁粉的化学方程式是_________(任写一个)。
(3)检验得到的铜是否含铁粉的的操作是__________。
(4)途径2与途径1比较,途径2优点是__________。
【答案】+6 Fe、Cu Fe+H2SO4![]() FeSO4+H2↑(或Fe+CuSO4
FeSO4+H2↑(或Fe+CuSO4![]() FeSO4+Cu) 取得到的铜于试管中,加入稀盐酸(或取得到的铜,用磁铁吸引,操作合理就得分) 得到更多的铜(或使混合物中的铜元素全部回收)
FeSO4+Cu) 取得到的铜于试管中,加入稀盐酸(或取得到的铜,用磁铁吸引,操作合理就得分) 得到更多的铜(或使混合物中的铜元素全部回收)
【解析】
(1)H2SO4中,H的化合价为+1,O的化合价为﹣2价,根据化合物中元素的化合价代数和为0的原则,设硫的化合价为x,则+1×2+x+(-2)×4=0,x=+6,所以硫的化合价为+6价,故填+6。
(2)根据反应流程及反应物和生成物分析,固体B所含的物质是被铁置换出的铜和剩余的铁,其化学式为:Fe、Cu,故填Fe、Cu;
氧化铜与硫酸反应生成硫酸铜和水,过滤后的滤液A中含有硫酸铜和剩余的稀硫酸,加入铁粉,硫酸铜和铁粉反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4![]() FeSO4+Cu,硫酸与铁反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+H2SO4
FeSO4+Cu,硫酸与铁反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+H2SO4![]() FeSO4+H2↑,故填 Fe+H2SO4
FeSO4+H2↑,故填 Fe+H2SO4![]() FeSO4+H2↑(或Fe+CuSO4
FeSO4+H2↑(或Fe+CuSO4![]() FeSO4+Cu)。
FeSO4+Cu)。
(3)检验得到的铜是否含铁粉的操作是:取少量固体滴入稀盐酸,观察是否有气泡产生,有气泡产生即为有铁粉,否则没有;或取得到的铜,用磁铁吸引,故填取得到的铜于试管中,加入稀盐酸(或取得到的铜,用磁铁吸引,操作合理就得分)。
(4)途径Ⅱ与途径Ⅰ比较,Ⅱ的优点是直接除去木炭粉,简化了实验步骤,同时混合物中的铜加热后可以转化为氧化铜,且氧化铜可以与稀硫酸反应生成硫酸铜,从而使最终制得的铜的量变多,故填得到更多的铜(或使混合物中的铜元素全部回收)。

【题目】如图1是以石灰石为原料制备高纯超细碳酸钙的工艺流程图:

(1)流程中操作A的名称_____。实验室里该操作用到的玻璃仪器有烧杯、_____和_____。
(2)主要反应原理:
①“煅烧”步骤:主要反应的化学方程式为_____,反应基本类型为_____反应。
②“浸出”步骤:CaO+2NH4Cl=CaCl2+H2O+2NH3↑。
③“碳化”步骤:CO2+2NH3+H2O+CaCl2=CaCO3↓+2 NH4Cl。
(3)煅烧石灰石得到的固体中,除含CaO外,还含有少量MgO、FeO等杂质,在“浸出”过程为保证铁、镁等杂质不被浸出,需要适当提高溶液的pH.根据反应②计算出的钙铵比(参加反应的氧化钙和氯化铵的质量比)为_____,而实际流程中最佳钙铵比要稍高于这一比值,原因是_____。
(4)用上述流程可循环使用的物质除了H2O、CO2和NH3之外,还有_____。
(5)实验室在如图2装置中模拟上述流程制备高纯超细碳酸钙:

①搅拌的作用是_____。
②制备CaCl2溶液时需要对装置加热,主要作用是_____。
A 加快反应速率 B 促进氨气逸出
③已知在常温和一个标准大气压下,CO2和NH3在100g水中分别能溶解0.169g和52.9g。制备CaCO3时应先通入氨气后通入二氧化碳,理由是_____。
④浸取一步中NH4Cl溶液的溶质质量分数直接影响着生成CaCl2溶液溶质质量分数。已知0﹣100℃时NH4Cl的溶解度如下表:
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
溶解(g) | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 |
如果用200g 80℃时NH4Cl的饱和溶液与纯氧化钙恰好完全反应,计算充分反应后得到CaCl2的质量_____。(写出计算过程,保留一位小数。)