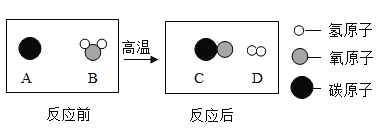
题目内容
【题目】某废旧金属中含有铜、金(Au)和镍(Ni),回收 Au 并制备 CuSO45H2O 晶体的流程如下:
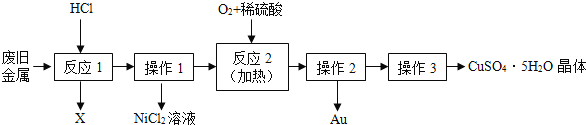
(1)操作1和操作2都用到的玻璃仪器为_____、烧杯和玻璃棒。
(2)反应2的化学方程式为:2Cu+O2+2H2SO4![]() 2_____+2H2O。
2_____+2H2O。
(3)操作3是指蒸发浓缩、_____结晶、过滤等。
【答案】漏斗 CuSO4 降温或冷却
【解析】
(1)分析整个流程得知:操作 1 和操作 2 都是过滤操作,用到的玻璃仪器有漏斗、烧杯、玻璃棒,所以答案为漏斗;
(2)根据质量守恒定律计算,生成物还缺少的物质的化学式为CuSO4;
(3)操作得到的是硫酸铜溶液,为了得到CuSO45H2O 晶体,要经过的操作有蒸发浓缩、降温结晶、过滤等。

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
【题目】马英同学取某地石灰石样品12g进行测定实验,现将100g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如下表所示:
加入稀盐酸的质量/g | 生成气体的总质量/g | |
第1次 | 20 | 1.1 |
第2次 | 20 | 2.2 |
第3次 | 20 | m |
第4次 | 20 | 4.4 |
第5次 | 20 | 4.4 |
(1)m的值为_________g
(2)12g石灰石样品中碳酸钙的质量等于_________g
(3)反应完全后最终溶液中氯化钙的质量分数为_______?(写出计算过程,计算结果精确至0.1)