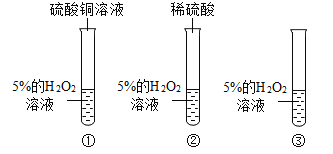
题目内容
【题目】有一不纯的Na2CO3样品,杂质可能是K2CO3、FeCl3、CaCO3和NaCl中的一种或几种,取该样品10.6克,加入足量的稀盐酸完全反应得到无色溶液,同时产生4.48克气体,下列判断正确的是( )
A. 杂质一定有FeCl3和CaCO3
B. 杂质一定没有NaCl
C. 杂质可能是K2CO3、CaCO3和NaCl组成
D. 杂质可能是K2CO3和NaCl组成
【答案】C
【解析】
氯化铁溶液为棕黄色,完全反应得到无色溶液,说明样品中无氯化铁,故A错误;
设:生成4.48g二氧化碳需要碳酸钠的质量为x。
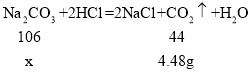
![]() x≈10.8g
x≈10.8g
设:生成4.48g二氧化碳需要碳酸钙的质量为y。
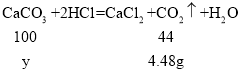
![]() y≈10.2g
y≈10.2g
设:生成4.48g二氧化碳需要碳酸钾的质量为z。
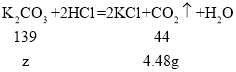
![]() z≈14.1g
z≈14.1g
样品10.6克,生成二氧化碳4.48g,其中混有的杂质一种产生二氧化碳的能力比碳酸钠强,因此杂质中一定含CaCO3,可能含K2CO3和NaCl中的一种或两种。故选C。

 阅读快车系列答案
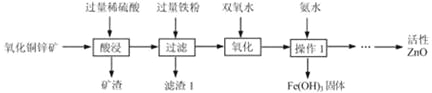
阅读快车系列答案【题目】如图1是以石灰石为原料制备高纯超细碳酸钙的工艺流程图:

(1)流程中操作A的名称_____。实验室里该操作用到的玻璃仪器有烧杯、_____和_____。
(2)主要反应原理:
①“煅烧”步骤:主要反应的化学方程式为_____,反应基本类型为_____反应。
②“浸出”步骤:CaO+2NH4Cl=CaCl2+H2O+2NH3↑。
③“碳化”步骤:CO2+2NH3+H2O+CaCl2=CaCO3↓+2 NH4Cl。
(3)煅烧石灰石得到的固体中,除含CaO外,还含有少量MgO、FeO等杂质,在“浸出”过程为保证铁、镁等杂质不被浸出,需要适当提高溶液的pH.根据反应②计算出的钙铵比(参加反应的氧化钙和氯化铵的质量比)为_____,而实际流程中最佳钙铵比要稍高于这一比值,原因是_____。
(4)用上述流程可循环使用的物质除了H2O、CO2和NH3之外,还有_____。
(5)实验室在如图2装置中模拟上述流程制备高纯超细碳酸钙:

①搅拌的作用是_____。
②制备CaCl2溶液时需要对装置加热,主要作用是_____。
A 加快反应速率 B 促进氨气逸出
③已知在常温和一个标准大气压下,CO2和NH3在100g水中分别能溶解0.169g和52.9g。制备CaCO3时应先通入氨气后通入二氧化碳,理由是_____。
④浸取一步中NH4Cl溶液的溶质质量分数直接影响着生成CaCl2溶液溶质质量分数。已知0﹣100℃时NH4Cl的溶解度如下表:
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
溶解(g) | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 |
如果用200g 80℃时NH4Cl的饱和溶液与纯氧化钙恰好完全反应,计算充分反应后得到CaCl2的质量_____。(写出计算过程,保留一位小数。)