题目内容
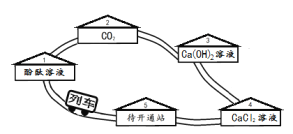
【题目】在学习碳酸钠的化学性质时,甲、乙两位同学分别取20%的碳酸钠溶液和10%的稀盐酸做了如图所示实验。

【实验现象】甲同学的实验中有气泡冒出,乙同学的实验中无气泡冒出。写出甲同学实验的化学方程式___________________。
【提出问题】乙同学的实验中溶液为什么没有明显的现象?
【查阅资料】①碳酸钠和稀盐酸反应仅可以生成二氧化碳,还可以生成碳酸氢钠。
②碳酸钠和氯化钙溶液混合能发生反应,碳酸氢钠和氯化钙溶液混合不发生反应。
【实验设计】证明乙同学所得溶液中含有碳酸钠、碳酸氢钠。
实验步骤 | 实验现象 | 实验结论 |
取适量乙同学实验后的溶液于试管中,加入足量氯化钙溶液 | ___________________ | 乙同学实验溶液中含有碳酸钠和碳酸氢钠 |
取步骤①所得上层清液少量,滴加 _____________________________ | ______________________ |
【实验反思】
(1)碳酸钠和盐酸反应生成物受到盐酸量的影响,稀盐酸_________ (填“过量”或“不足”)时才能有气泡冒出。
(2)当反应物的量不同,生成物可能不同,试另举一例:___________________________。
【注意:若答对以下问题奖励4分,化学试卷总分不超过60分。】
【拓展延伸】欲检验某敞口的试剂瓶中氢氧化钠溶液是否变质,某同学取5ml该液体,滴加少量稀盐酸发现无气泡冒出,证明此氢氧化钠溶液没有变质,同学们认为该结论不合理。 请解释可能的原因为:①_________________________________________;②________________________________________________________________。
为了得到正确的结论,你的改进的方案是___________________________。
【答案】 Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ 有白色沉淀产生 稀盐酸(或稀硫酸) 有气泡产生 过量 碳在充足氧气中燃烧生成二氧化碳,氧气不足时生成一氧化碳(合理即可) 可能部分变质,溶液中未变质的氢氧化钠与盐酸先反应 可能全部变质,碳酸钠与少量的盐酸反应生成碳酸氢钠 取少量溶液于试管中,加入过量的稀盐酸,观察是否有气泡产生。若有气泡,说明溶液变质了;若没有气泡则没有变质
【解析】【实验现象】根据反应原理结合化学方程式书写规则书写;
【实验设计】根据实验步骤、实验结论分析解答;
【实验反思】根据反应物的量分析;
【拓展延伸】根据实验中可能影响实验的因素分析解答。
解:【实验现象】反应物是碳酸钠和稀盐酸,故甲同学实验的化学方程式Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑;
【实验设计】从实验结论可知乙同学实验溶液中含有碳酸钠,故取适量乙同学实验后的溶液于试管中,加入足量氯化钙溶液后,碳酸钠与氯化钙溶液反应生成碳酸钙的白色沉淀和氯化钠。故实验现象是有白色沉淀产生;由已知碳酸氢钠与稀盐酸反应生成二氧化碳气体,故是加入稀盐酸,产生大量气泡,说明乙同学实验的溶液中含有碳酸氢钠;
【实验反思】(1)碳酸钠溶液和稀盐酸反应先生成碳酸氢钠,盐酸有剩余,继续与生成的碳酸氢钠反应生成二氧化碳气体,故稀盐酸过量时才能观察到产生气泡的现象;
(2)当反应物的量不同,生成物可能不同,试另举一例:碳在充足氧气中燃烧生成二氧化碳,氧气不足时生成一氧化碳(合理即可);
【拓展延伸】由于滴加的稀盐酸的量较少。可能的原因为:①可能部分变质,溶液中未变质的氢氧化钠与盐酸先反应完;
②可能全部变质,碳酸钠与少量的盐酸反应生成碳酸氢钠;
检验某敞口的试剂瓶中氢氧化钠溶液是否变质,即检验是否有碳酸根的存在,因此需加入过量稀盐酸。故为了得到正确的结论,你的改进的方案是取少量溶液于试管中,加入过量的稀盐酸,观察是否有气泡产生。若有气泡,说明溶液变质了;若没有气泡则没有变质。