题目内容
在托盘天平的两边各放一只烧杯,在两烧杯中分别注入相同质量分数、等质量且足量的稀硫酸,调节至平衡.现向左边烧杯中投入20.8g10%的氯化钡溶液,向右边烧杯中投入21.2g铁与铜的混合物,充分反应后,天平重新平衡,则混合物中铁的质量为
- A.5.6g
- B.11.2g
- C.2.8g
- D.无法计算
B
分析:根据烧杯内质量的增加量考虑,加入的金属质量减去跑出去的气体质量就是增加值,如果两边增加量相等,则天平平衡,据此结合相关的反应情况根据化学方程式的分析判断.
解答:左边烧杯中投入20.8g10%的氯化钡溶液,氯化钡与稀硫酸反应因为没有气体放出,所以左边的增重为20.8g,要想天平平衡,则右边的增重也应为20.8g,所以铁与硫酸反应时(铜不能与硫酸反应生成氢气)生成的氢气质量应该是:21.2g-20.8g=0.4g
设参与反应的铁的质量是x
Fe+H2SO4═FeSO4+H2↑
56 2
x 0.4g
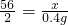
x=11.2g
故选B
点评:解答本题的关键是比较出烧杯中质量的增加量,根据增加量相等,天平能够平衡的规律,计算时增加量要根据加入的质量-跑出去的质量来算.
分析:根据烧杯内质量的增加量考虑,加入的金属质量减去跑出去的气体质量就是增加值,如果两边增加量相等,则天平平衡,据此结合相关的反应情况根据化学方程式的分析判断.
解答:左边烧杯中投入20.8g10%的氯化钡溶液,氯化钡与稀硫酸反应因为没有气体放出,所以左边的增重为20.8g,要想天平平衡,则右边的增重也应为20.8g,所以铁与硫酸反应时(铜不能与硫酸反应生成氢气)生成的氢气质量应该是:21.2g-20.8g=0.4g
设参与反应的铁的质量是x
Fe+H2SO4═FeSO4+H2↑
56 2
x 0.4g
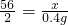
x=11.2g
故选B
点评:解答本题的关键是比较出烧杯中质量的增加量,根据增加量相等,天平能够平衡的规律,计算时增加量要根据加入的质量-跑出去的质量来算.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目