题目内容
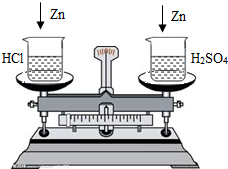
在托盘天平的两边各放一只等质量的烧杯,向两只烧杯中分别注入相同质量、相同质量分数的盐酸和稀硫酸,天平平衡.(1)若向两烧杯中分别投入等质量的锌粒(如图所示),待充分反应后,发现两烧杯中锌粒均有剩余,则天平指针
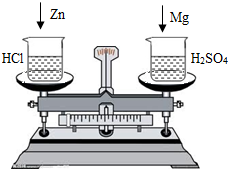
(2)若向左边烧杯中投入少量的锌粒,向右边烧杯中投入等质量的镁条(如图所示),待充分反应后,发现锌粒和镁条全部溶解,则天平指针
分析:根据金属与酸反应的化学方程式进行计算,可以从金属足量以及酸足量的角度进行分析完成.
解答:解:(1)两烧杯中锌粒均有剩余,则酸全部参加反应,设酸的质量是98,盐酸反应生成的氢气的质量为x,
Zn+2HCl═ZnCl2+H2↑
73 2
98 x
=
x=2.7
Zn+H2SO4═ZnSO4+H2↑
98 2
可以看出盐酸生成的氢气质量比硫酸生成的氢气的质量多,故天平指针会指向硫酸一端,所以本题答案为:向右;
(2)锌粒和镁条全部溶解,说明酸足量,设金属的质量为65,镁生成的氢气质量为y
Zn+2HCl═ZnCl2+H2↑
65 2
Mg+H2SO4═MgSO4+H2↑
24 2
65 y
=
y=5.4
可以看出镁生成的氢气质量比锌多,故天平指针会指向加锌的一端,所以本题答案为:向左.
Zn+2HCl═ZnCl2+H2↑
73 2
98 x
| 73 |
| 98 |
| 2 |
| x |
x=2.7
Zn+H2SO4═ZnSO4+H2↑
98 2
可以看出盐酸生成的氢气质量比硫酸生成的氢气的质量多,故天平指针会指向硫酸一端,所以本题答案为:向右;
(2)锌粒和镁条全部溶解,说明酸足量,设金属的质量为65,镁生成的氢气质量为y
Zn+2HCl═ZnCl2+H2↑
65 2
Mg+H2SO4═MgSO4+H2↑
24 2
65 y
| 24 |
| 65 |
| 2 |
| y |
y=5.4
可以看出镁生成的氢气质量比锌多,故天平指针会指向加锌的一端,所以本题答案为:向左.
点评:本题考查了金属与酸反应生成氢气质量的关系,完成此题,可以依据反应的化学方程式,从酸的质量和金属的质量的角度进行.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目