题目内容
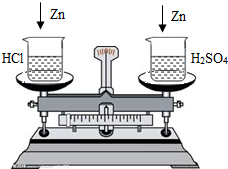
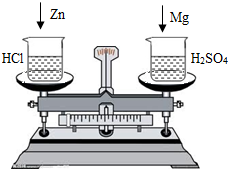
12、在托盘天平的两边各放一只盛有50g 14.6%的稀盐酸的烧杯,调节天平至平衡.分别向两烧杯中加入下列各组物质,充分反应后,天平仍然平衡的是( )
分析:根据化学方程式的计算,判断两端加入一定量物质后增加质量是否相等,增加质量相等时天平才能仍然保持平衡.
解答:解:A、50g 14.6%的稀盐酸中HCl质量=50g×14.6%=7.3g
50g 14.6%的稀盐酸完全反应消耗金属铝和镁的质量分别为:
2Al~6HCl
54 219
mAl 7.3g
54:219=mAl:7.3g 解这之得 mAl=1.8g
Mg~2HCl
24 73
mMg 7.3g
24:73=mMg:7.3g 解这之得 mMg=2.4g
则金属铝、镁均未完全反应,盐酸量不足,充分反应放出氢气质量相等;天平仍然保持平衡;
B、NaOH与盐酸反应不产生气体,因此增加的质量即为加入的NaOH溶液质量10.6g;而Na2CO3与盐酸反应放出气体二氧化碳,所以增加的质量小于加入的Na2CO3溶液质量,即增加的质量小于10.6g;两端增加质量不相等,天平失去平衡;
C、50g 14.6%的稀盐酸完全反应消耗金属铁和锌的质量分别为:
Fe~2HCl
56 73
mFe7.3g
56:73=mFe:7.3g 解这之得 mFe=5.6g
Zn~2HCl
65 73
mZn7.3g
65:73=mZn:7.3g 解这之得 mZn=6.5g
则金属铁、锌均与稀盐酸恰好完全反应,反应放出氢气质量相等;但加入金属质量不等,天平失去平衡;
D、50g 14.6%的稀盐酸完全反应消耗碳酸镁和碳酸钙的质量分别为x和y
MgCO3~2HCl
84 73
x 7.3g
84:73=x:7.3g x=8.4g
CaCO3~2HCl
100 73
y 7.3g
100:73=y:7.3g y=10g
8.4gMgCO3和8.4gCaCO3均完全反应,但反应放出二氧化碳气体质量不相同,因此,天平失去平衡;
故选A
50g 14.6%的稀盐酸完全反应消耗金属铝和镁的质量分别为:
2Al~6HCl
54 219
mAl 7.3g
54:219=mAl:7.3g 解这之得 mAl=1.8g
Mg~2HCl
24 73
mMg 7.3g
24:73=mMg:7.3g 解这之得 mMg=2.4g
则金属铝、镁均未完全反应,盐酸量不足,充分反应放出氢气质量相等;天平仍然保持平衡;
B、NaOH与盐酸反应不产生气体,因此增加的质量即为加入的NaOH溶液质量10.6g;而Na2CO3与盐酸反应放出气体二氧化碳,所以增加的质量小于加入的Na2CO3溶液质量,即增加的质量小于10.6g;两端增加质量不相等,天平失去平衡;
C、50g 14.6%的稀盐酸完全反应消耗金属铁和锌的质量分别为:
Fe~2HCl
56 73
mFe7.3g
56:73=mFe:7.3g 解这之得 mFe=5.6g
Zn~2HCl
65 73
mZn7.3g
65:73=mZn:7.3g 解这之得 mZn=6.5g
则金属铁、锌均与稀盐酸恰好完全反应,反应放出氢气质量相等;但加入金属质量不等,天平失去平衡;
D、50g 14.6%的稀盐酸完全反应消耗碳酸镁和碳酸钙的质量分别为x和y
MgCO3~2HCl
84 73
x 7.3g
84:73=x:7.3g x=8.4g
CaCO3~2HCl
100 73
y 7.3g
100:73=y:7.3g y=10g
8.4gMgCO3和8.4gCaCO3均完全反应,但反应放出二氧化碳气体质量不相同,因此,天平失去平衡;
故选A
点评:加入物质充分反应后,天平一端增加的质量=加入固体质量-放出气体的质量,只有加入物质与放出气体质量均相等时,天平才能保持平衡.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目