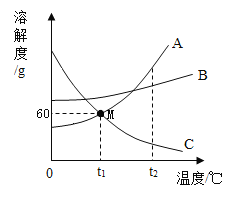
题目内容
【题目】结合下图所示实验流程,回答问题。
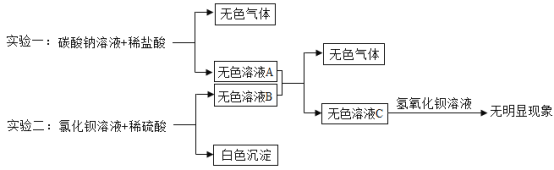
(1)写出无色溶液A中阴离子的符号_____。
(2)写出实验二反应的化学方程式_____。
(3)将无色气体通入到Ba(OH)2溶液中,会观察到的现象是_____。
(4)进一步确定无色溶液C中溶质的成分,取样无色溶液C,滴加过量的试剂是_____。
【答案】CO32-、Cl- ![]() 产生白色沉淀(或溶液变浑浊) Na2CO3溶液(或K2CO3溶液)
产生白色沉淀(或溶液变浑浊) Na2CO3溶液(或K2CO3溶液)
【解析】
实验一:碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,故无色气体是二氧化碳,无色溶液A中一定有氯化钠,可能有碳酸钠或稀盐酸;实验二:氯化钡和稀硫酸反应生成硫酸钡沉淀和盐酸,故白色沉淀是硫酸钡,无色溶液B中一定有盐酸,可能有氯化钡或稀硫酸;无色溶液A和无色溶液B反应生成无色气体和无色溶液,说明无色溶液A中含有碳酸钠,碳酸钠和无色溶液B中的盐酸反应生成氯化钠、二氧化碳和水,再向无色溶液C中加入氢氧化钡溶液,无明显现象,说明无色溶液C中不含稀硫酸和碳酸钠。
(1)根据分析可知,无色溶液A中有氯化钠和碳酸钠,则阴离子为CO32-、Cl-;
(2)实验二是氯化钡和稀硫酸反应生成硫酸钡沉淀和盐酸,化学方程式为:![]() ;
;
(3)将无色气体通入到Ba(OH)2溶液中,二氧化碳和氢氧化钡反应生成碳酸钡沉淀和水,所以会观察到的现象是产生白色沉淀;
(4)根据分析可知,无色溶液C中一定含有氯化钠,可能含有稀盐酸、氯化钡,为进一步确定无色溶液C中溶质的成分,取样无色溶液C,滴加过量的碳酸钠溶液,若产生气泡,不产生白色沉淀,则说明含有稀盐酸,不含氯化钡;若产生白色沉淀,不产生气泡,则说明含有氯化钡,不含稀盐酸;若既产生气泡,又产生白色沉淀,则说明含有稀盐酸、氯化钡。

 名校课堂系列答案
名校课堂系列答案【题目】某中学的一个化学兴趣小组用石灰石和盐酸制取一瓶CO2,验满后,将澄清石灰水倒入集气瓶中,发现没有变浑浊。兴趣小组对这个异常现象进行了探究。
[提出问题]澄清石灰水为什么没有变浑浊?
[查阅资料] (1)CO2过量时,CaCO3沉淀会转化为可溶于水的Ca(HCO3)2
(2)AgCl不溶于稀硝酸
[提出猜想]Ⅰ、石灰水已完全变质Ⅱ、_____Ⅲ。 CO2 中混有HCl
[实验方案]兴趣小组用原药品继续制取CO2,并进行探究。制备CO2的化学方程式为_____。
步骤 | 实验操作 | 实验现象 | 结论及化学方程式 |
(1) | 取少量澄清石灰水于试管中,加入碳酸钠溶液。 | 产生白色沉淀。 | 猜想I不成立。 |
(2) | 将少量气体通入盛有澄清石灰水的试管中。 | _____ | 猜想Ⅱ不成立。 |
(3) | 将气体通入盛有硝酸银溶液的试管中,再加稀硝酸。 | 产生白色沉淀 | 猜想Ⅲ成立。反应方程式为 _____ |
[实验结论]制取的CO2气体中混入了HCl,所以澄清石灰水没有变浑浊。
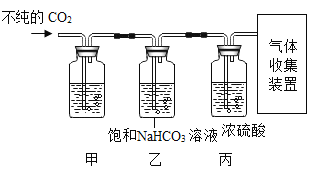
[交流讨论]若要收集到纯净、干燥的CO2,需将混合气体依次通入饱和NaHCO3溶液和_____。
[拓展思考]回忆课本中收集呼出气体的操作后,同学们尝试用排水法收集一瓶CO2,倒入澄清石灰水后,石灰水变浑浊。你认为该实验成功的原因是_____(写一点)。
【题目】(1)水和溶液对人类的生产、生活具有重要意义。
① 水是生命之源,人类社会发展离不开水。自来水厂将带有病菌的天然水经处理后达到饮用水标准,其中最关键的水处理环节是______。
A 沉降 B 过滤 C 吸附 D 杀菌
② 下列有关水的说法正确的是________。
A 电解水实验证明:水是由氢气和氧气组成的。
B 电解水的实验中,得到的氢气与氧气体积比为1∶2。
C 天然水多为硬水,日常生活中可用煮沸的方法降低水的硬度。
D 地球上的水储量是丰富的,可供利用的淡水资源也是无限的。
③ 生理盐水中的溶质是_____________(填化学式)。现欲配制一瓶500g溶质质量分数为0.9%的生理盐水,下列实验操作与目的分析均正确的是__________。
实验操作 | 目的分析 | |
A | 称量时,将取出的过量药品放回原瓶 | 节约药品 |
B | 溶解时用玻璃棒搅拌 | 增大溶解度 |
C | 称量时,在天平两边托盘上各放一张质量相等的纸 | 整洁美观 |
D | 量取所需水时,视线与量筒内液体凹液面最低处保持水平 | 准确读数 |
(2)根据下列图文回答问题:
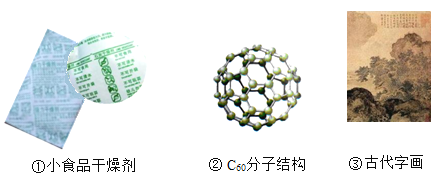
图①:干燥剂的主要成分为生石灰,用化学方程式表示其干燥原理_________________。
图②:一个C60分子是由_____________构成的。
图③:古代字画能够保存很长时间不褪色的原因是_______________________。