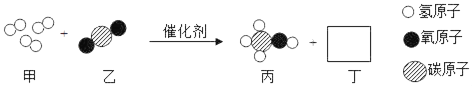
题目内容
【题目】日常使用的干电池是一种锌锰电池,它的构造是:负极为锌做的圆筒,正极是一根碳棒,它的周围被二氧化锰,碳粉和氯化铵的混合剂所包围,总称为“碳包”。碳包和锌筒之间填充着氯化铵、氯化锌的水溶液等组成的糊状物。废旧干电池随意丢弃会造成环境污染,学校兴趣小组同学准备对废旧的干电池进行探究。
(一)拆解干电池,得到铜帽、锌皮、碳棒、黑色粉末等物质。
(二)回收二氧化锰并测定碳粉与二氧化锰的质量比:(如图)
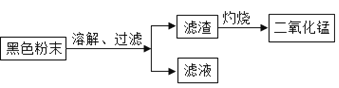
(1)干电池使用时将化学能转化成________能。
(2)上述操作中,灼烧过程中发生的反应用化学方程式表示为__________。
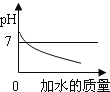
(3)同学们将过滤后得到的滤渣干燥后称得质量为25g,充分灼烧后冷却称得剩余固体质量为20g,则滤渣中二氧化锰与碳粉的质量比为_____,经分析此结果偏大,老师指出同学们在实验中缺少一步操作,该操作是_______________。
(4)为验证二氧化锰,同学们用 A、B两支洁净试管,分别取5mL3%的过氧化氢溶液,往A试管中加入少量上述实验灼烧后得到的固体,如果出现______的现象,说明为二氧化锰,反应的化学方程式为________。
(三)用拆解得到的锌皮(含杂质)制取硫酸锌晶体。实验步骤:
①将剪碎后的锌皮放入烧杯中,加入足量的稀硫酸,充分反应; |
②将上述反应后的混合物过滤; |
③将滤液加热浓缩、_____、过滤,洗涤、低温干燥,得到 ZnSO47H2O 晶体。 |
(5)步骤①中反应方程式为_____________,将锌皮剪碎的目的是_______。
(6)步骤②需要的仪器有铁架台、烧杯、_____和玻璃棒,玻璃棒的作用是_____。
(7)步骤③缺少的操作是_____,洗涤时不能选用_____(填序号)。
A.60℃热水 B.冰水 C.硫酸锌饱和溶液
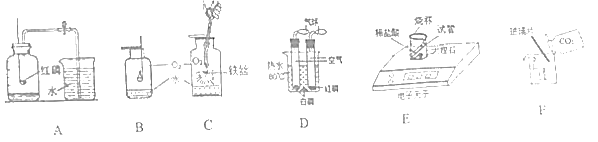
(四)测定锌皮中锌的质量分数。同学们设计了如图实验装置,取 1g 锌皮放于试管中, 实验中将注射器内40毫升稀硫酸(足量)完全注入试管中。当试管中不再产生气泡时立刻读数得到量筒中水的体积为264毫升。已知实验条件下氢气的密度为0.09g/L。
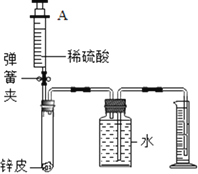
(8)计算该锌皮中锌的质量分数_____。
(9)上述方法测得的锌的质量分数偏大,可能的原因是_____(填序号)。
A.未等装置完全冷却就读数
B.锌皮中含有少量铁
C.试管中有气体没有排出
D.将注射器中稀硫酸全部注入试管中后忘掉夹紧弹簧夹
【答案】电 C+O2![]() CO2 4:1 洗涤 有气泡产生 2H2O2
CO2 4:1 洗涤 有气泡产生 2H2O2![]() 2H2O+O2↑ 降温结晶 Zn+H2SO4═ZnSO4+H2↑ 增大接触面积,使之充分反应,加快反应速率 漏斗 引流 降温结晶 A 65% AB
2H2O+O2↑ 降温结晶 Zn+H2SO4═ZnSO4+H2↑ 增大接触面积,使之充分反应,加快反应速率 漏斗 引流 降温结晶 A 65% AB
【解析】
(二)(1)干电池使用时将化学能转化成电能;
(2)上述操作中灼烧时,碳粉和氧气反应生成二氧化碳,目的是除去碳粉,化学方程式表示为:C+O2![]() CO2;
CO2;
(3)则滤渣中二氧化锰与碳粉的质量比为:20g:(25g-20g)=4:1;经分析,此结果偏大,老师指出同学们在实验中缺少一步操作,该操作是洗涤,如果没有洗涤,溶于水的溶质部分会附着在滤渣上;
(4)往A试管中加入少量上述实验灼烧后得到的固体,如果产生大量气泡,说明为二氧化锰,这是因为过氧化氢在二氧化锰催化作用下分解生成水和氧气,反应的化学方程式为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(三)(5)步骤①中锌和稀硫酸反应生成硫酸锌和氢气,反应方程式为:Zn+H2SO4═ZnSO4+H2↑;将锌皮剪碎的目的是增大接触面积,使反应更快更充分;
(6)步骤②需要的仪器有铁架台、烧杯、漏斗和玻璃棒,玻璃棒的作用是引流;
(7)步骤③缺少的操作是降温结晶;若用60℃热水进行洗涤,会影响硫酸锌的结晶;
(四)(8)设锌的质量为x,生成氢气的质量:(264mL-40mL)x10-3L×0.09g/L=0.02g;
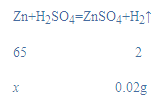
![]()
x=0.65g,
锌皮中锌的质量分数=![]() ×100%=65%;
×100%=65%;
(9)A、没等装置冷却就读数,会导致测定氢气的体积偏大,从而导致计算结果偏大;
B、锌皮中含有少量铁时,生成氢气质量大于是纯锌时生成的氢气质量,从而导致计算结果偏大;
C、试管中有气体没有排出,不影响计算结果,这是因为不管生成的气体是否排出试管,总是生成多少体积的气体,就有多少体积的水排入量筒;
D、将注射器中稀硫酸全部注入试管中后忘掉夹紧弹簧夹时,会导致测定氢气的体积偏小,从而导致计算结果偏小。