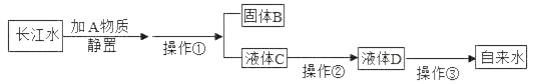
题目内容
【题目】向盛有60g 15%的氢氧化钡溶液的烧杯中,缓慢滴加稀硫酸至过量。烧杯中的某些量随着稀硫酸的滴加,其变化趋势肯定错误的是( )
A. 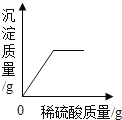 B.
B. 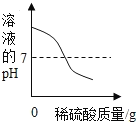
C. 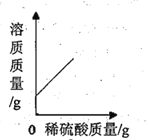 D.
D. 
【答案】C
【解析】
A、向盛有60g 15%的氢氧化钡溶液的烧杯中,缓慢滴加稀硫酸至过量,氢氧化钡溶液与稀硫酸反应生成硫酸钡沉淀和水,沉淀的质量逐渐增加,至完全反应不再发生改变,故选项图象变化趋势正确;
B、向盛有60g 15%的氢氧化钡溶液的烧杯中,缓慢滴加稀硫酸至过量,碱性逐渐变弱,酸性逐渐增强,pH值的变化是从大于7逐渐的减小到小于7,故选项图象变化趋势正确;
C、氢氧化钡溶液与稀硫酸反应生成硫酸钡沉淀和水,随着反应的进行,溶质质量逐渐减少,至完全反应减少至0,继续滴加稀硫酸,溶质质量又开始增加,故选项图象变化趋势错误;
D、该反应遵守质量守恒定律,反应前后烧杯中物质的总质量不变,故选项图象变化趋势正确。
故选C。

【题目】“舌尖上的中国”在央视上的热播让厨房再次成为人们施展厨艺的舞台大多数厨师有个工作经验:炒菜时,又加料酒又加醋,可使菜变得香美可口,原因是醋中的乙酸与料酒中的乙醇生成乙酸乙酯如表中是几种常见的酯,请完成下列问题。
酯的名称 | 甲酸甲酯 | 甲酸乙酯 | 乙酸甲酯 | 乙酸乙酯 |
化学式 | C2H4O2 | C3H6O2 | C3H6O2 | X |
(1)甲酸甲酯(C2H4O2)中碳元素、氧元素的质量比为______;
(2)甲酸乙酯(C3H6O2)中碳元素的质量分数为______(计算结果精确到0.1%);
【题目】日常使用的干电池是一种锌锰电池,它的构造是:负极为锌做的圆筒,正极是一根碳棒,它的周围被二氧化锰,碳粉和氯化铵的混合剂所包围,总称为“碳包”。碳包和锌筒之间填充着氯化铵、氯化锌的水溶液等组成的糊状物。废旧干电池随意丢弃会造成环境污染,学校兴趣小组同学准备对废旧的干电池进行探究。
(一)拆解干电池,得到铜帽、锌皮、碳棒、黑色粉末等物质。
(二)回收二氧化锰并测定碳粉与二氧化锰的质量比:(如图)
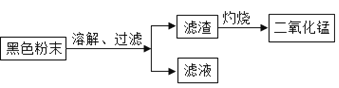
(1)干电池使用时将化学能转化成________能。
(2)上述操作中,灼烧过程中发生的反应用化学方程式表示为__________。
(3)同学们将过滤后得到的滤渣干燥后称得质量为25g,充分灼烧后冷却称得剩余固体质量为20g,则滤渣中二氧化锰与碳粉的质量比为_____,经分析此结果偏大,老师指出同学们在实验中缺少一步操作,该操作是_______________。
(4)为验证二氧化锰,同学们用 A、B两支洁净试管,分别取5mL3%的过氧化氢溶液,往A试管中加入少量上述实验灼烧后得到的固体,如果出现______的现象,说明为二氧化锰,反应的化学方程式为________。
(三)用拆解得到的锌皮(含杂质)制取硫酸锌晶体。实验步骤:
①将剪碎后的锌皮放入烧杯中,加入足量的稀硫酸,充分反应; |
②将上述反应后的混合物过滤; |
③将滤液加热浓缩、_____、过滤,洗涤、低温干燥,得到 ZnSO47H2O 晶体。 |
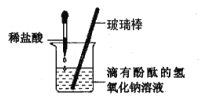
(5)步骤①中反应方程式为_____________,将锌皮剪碎的目的是_______。
(6)步骤②需要的仪器有铁架台、烧杯、_____和玻璃棒,玻璃棒的作用是_____。
(7)步骤③缺少的操作是_____,洗涤时不能选用_____(填序号)。
A.60℃热水 B.冰水 C.硫酸锌饱和溶液
(四)测定锌皮中锌的质量分数。同学们设计了如图实验装置,取 1g 锌皮放于试管中, 实验中将注射器内40毫升稀硫酸(足量)完全注入试管中。当试管中不再产生气泡时立刻读数得到量筒中水的体积为264毫升。已知实验条件下氢气的密度为0.09g/L。
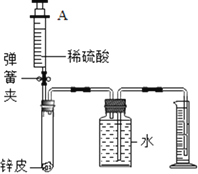
(8)计算该锌皮中锌的质量分数_____。
(9)上述方法测得的锌的质量分数偏大,可能的原因是_____(填序号)。
A.未等装置完全冷却就读数
B.锌皮中含有少量铁
C.试管中有气体没有排出
D.将注射器中稀硫酸全部注入试管中后忘掉夹紧弹簧夹