题目内容
【题目】根据下图所示实验,请回答相关问题:
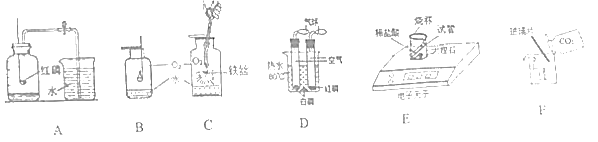
①图 A 红磷燃烧的化学方程式为_____ ;实验测得空气中氧气的体积分数小于 1/5,可能的原因是_________(写一条);
②B 中硫燃烧的现象是 ______,化学方程式为 ________;
③C 中反应的化学方程式是 ________,瓶底水的作用____________ ;
④D 白磷燃烧,红磷没有燃烧,说明探究可燃物燃烧的条件是______________________ ;
⑤图 E 中反应后天平示数减少,有人说该反应不符合质量守恒定律,你的观点是_________________ 。
⑥F 中将观察到阶梯上的蜡烛按_________ (填 “ 先上后下 ” 或 “ 先下后上 ” )的顺序熄灭,其原因是_______ ,该实验说明,二氧化碳具有__________ 的化学性质。
【答案】4P+5O2![]() 2P2O5 未冷却至室温即打开弹簧夹、红磷不足等 产生明亮的蓝紫色火焰、放热、产生有刺激性气味的气体 S+O2
2P2O5 未冷却至室温即打开弹簧夹、红磷不足等 产生明亮的蓝紫色火焰、放热、产生有刺激性气味的气体 S+O2![]() SO2 3Fe+2O2
SO2 3Fe+2O2![]() Fe3O4 防止高温熔融物溅落使瓶底炸裂 温度达到可燃物的着火点 符合质量守恒定律,减少的质量为产物 CO2的质量 先下后上 二氧化碳的密度比空气大 不可燃、不助燃
Fe3O4 防止高温熔融物溅落使瓶底炸裂 温度达到可燃物的着火点 符合质量守恒定律,减少的质量为产物 CO2的质量 先下后上 二氧化碳的密度比空气大 不可燃、不助燃
【解析】
(1)磷与氧气在点燃的条件下反应生成五氧化二磷,化学方程式为:4P+5O2![]() 2P2O5;若红磷的量不足、未冷却至室温就打开止水夹或装置漏气均会导致测定结果偏小;
2P2O5;若红磷的量不足、未冷却至室温就打开止水夹或装置漏气均会导致测定结果偏小;
(2)硫在氧气中燃烧发出明亮的蓝紫色火焰,放热、产生一种有刺激性气味的气体;硫与氧气在点燃的条件下反应生成二氧化硫;化学方程式为:S+O2![]() SO2;
SO2;
(3)铁与氧气在点燃的条件下反应生成四氧化三铁,化学方程式为:3Fe+2O2![]() Fe3O4;生成物的温度很高,为了防止高温生成物溅落、炸裂瓶底,需要在集气瓶内加入少量水或在瓶底铺一层细沙;
Fe3O4;生成物的温度很高,为了防止高温生成物溅落、炸裂瓶底,需要在集气瓶内加入少量水或在瓶底铺一层细沙;
(4)试管中的白磷与红磷均与氧气接触,试管中的白磷燃烧而红磷没有燃烧,说明可燃物燃烧温度达到可燃物的着火点;
(5)装置E中将盐酸与大理石混合,反应停止后,天平不平衡,因为盐酸与碳酸钙反应生成二氧化碳气体,逸入空气,因此质量减少;
(6)因为二氧化碳的密度比空气大,所以F中观察到蜡烛下层先熄灭,上层蜡烛后熄灭,实验还说明二氧化碳具有的化学性质是不燃烧不支持燃烧。

【题目】日常使用的干电池是一种锌锰电池,它的构造是:负极为锌做的圆筒,正极是一根碳棒,它的周围被二氧化锰,碳粉和氯化铵的混合剂所包围,总称为“碳包”。碳包和锌筒之间填充着氯化铵、氯化锌的水溶液等组成的糊状物。废旧干电池随意丢弃会造成环境污染,学校兴趣小组同学准备对废旧的干电池进行探究。
(一)拆解干电池,得到铜帽、锌皮、碳棒、黑色粉末等物质。
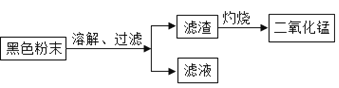
(二)回收二氧化锰并测定碳粉与二氧化锰的质量比:(如图)
(1)干电池使用时将化学能转化成________能。
(2)上述操作中,灼烧过程中发生的反应用化学方程式表示为__________。
(3)同学们将过滤后得到的滤渣干燥后称得质量为25g,充分灼烧后冷却称得剩余固体质量为20g,则滤渣中二氧化锰与碳粉的质量比为_____,经分析此结果偏大,老师指出同学们在实验中缺少一步操作,该操作是_______________。
(4)为验证二氧化锰,同学们用 A、B两支洁净试管,分别取5mL3%的过氧化氢溶液,往A试管中加入少量上述实验灼烧后得到的固体,如果出现______的现象,说明为二氧化锰,反应的化学方程式为________。
(三)用拆解得到的锌皮(含杂质)制取硫酸锌晶体。实验步骤:
①将剪碎后的锌皮放入烧杯中,加入足量的稀硫酸,充分反应; |
②将上述反应后的混合物过滤; |
③将滤液加热浓缩、_____、过滤,洗涤、低温干燥,得到 ZnSO47H2O 晶体。 |
(5)步骤①中反应方程式为_____________,将锌皮剪碎的目的是_______。
(6)步骤②需要的仪器有铁架台、烧杯、_____和玻璃棒,玻璃棒的作用是_____。
(7)步骤③缺少的操作是_____,洗涤时不能选用_____(填序号)。
A.60℃热水 B.冰水 C.硫酸锌饱和溶液
(四)测定锌皮中锌的质量分数。同学们设计了如图实验装置,取 1g 锌皮放于试管中, 实验中将注射器内40毫升稀硫酸(足量)完全注入试管中。当试管中不再产生气泡时立刻读数得到量筒中水的体积为264毫升。已知实验条件下氢气的密度为0.09g/L。
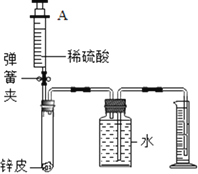
(8)计算该锌皮中锌的质量分数_____。
(9)上述方法测得的锌的质量分数偏大,可能的原因是_____(填序号)。
A.未等装置完全冷却就读数
B.锌皮中含有少量铁
C.试管中有气体没有排出
D.将注射器中稀硫酸全部注入试管中后忘掉夹紧弹簧夹
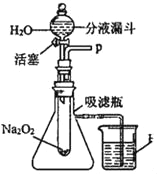
【题目】在学校的元旦联欢会上,默默同学表演了“水能生火”的魔术。他向包有过氧化钠 (Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来。这是什么原因呢?请你和小明同学进行实验探究。
[提出问题]过氧化钠与水反应生成了什么物质?为什么脱脂棉会燃烧?
[猜想]①可能有一种气体和另种物质生成;②反应过程中可能有能量变化
[实验探究]设计了如图所示的装置进行探究
[已知]碳酸钠同碳酸钙一样能与盐酸发生类似的化学反应。
实验一:探究反应后生成的气体是什么?
(1)打开如图装置中分液漏斗的活塞,控制滴加水的速率,观察活塞到试管内有气泡产生,用带火星的木条靠近P处,木条复燃。说明生成的气体是_____。
(2)实验中,还观察到伸入烧杯中的导管口有气泡冒出,请解释产生该现象的原因是:_____
实验二:探究反应后生成的另一种物质是什么?
①千贺同学猜想另一种物质可能是Na2CO3,为了证实千贺同学的猜想,请你设计一个实验:证明生成物中没有Na2CO3
实验操作 | 实验现象 | 实验结论 |
②暖心同学认为不做上述实验也可以从理论上说明千贺同学的猜想是错误的,请你说出暖心同学的理由:_____。
③飞舟同学猜想另一种生成物为氢氧化钠 (NaOH),老师告诉飞舟同学:你的猜想是正确的,请你试着写出该反应的化学方程式:_____。