题目内容
【题目】CO是一种无色无味、有毒的可燃气体,具有还原性,可用于冶金工业。某兴趣小组为探究其具有还原性,设计了如下实验装置。请回答以下有关问题:
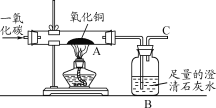
(1)CO气体能使人中毒,其原因是______。
(2)实验开始时,先通入CO一段时间后,再加热,其原因是______。
(3)实验过程中,图中A处观察到的实验现象是_____,发生反应的化学方程式为_____。
(4)该装置存在的一个主要问题是_____。
【答案】CO极易与血液中的血红蛋白结合,从而使血红蛋白不能再与氧结合,造成人体内缺氧 排尽玻璃管内的空气,防止加热时发生爆炸 黑色粉末变成红色C CuO+CO![]() Cu+CO2 缺少尾气处理装置
Cu+CO2 缺少尾气处理装置
【解析】
(1)一氧化碳中毒机理是一氧化碳与血红蛋白的亲合力比氧与血红蛋白的亲合力高200~300倍,所以一氧化碳极易与血红蛋白结合,形成碳氧血红蛋白,使血红蛋白丧失携氧的能力和作用,造成组织窒息。
(2)一氧化碳具有可燃性,和氧气混合在点燃的条件下会发生爆炸,故实验开始时,先通入CO一段时间后,再加热,是为了排尽装置内的空气,防止加热时发生爆炸。
(3)一氧化碳还原氧化铜在加热的条件下生成铜和二氧化碳,氧化铜是黑色粉末,铜是红色的固体,故现象为:粉末由黑色逐渐变成红色,化学方程式为CuO+CO![]() Cu+CO2。
Cu+CO2。
(4)一氧化碳有毒,直接排入空气中会污染空气,故应在C处加一个尾气处理装置。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案【题目】化学实验小组设计如图装置:通过测定产生相同体积气体所用时间长短来探究影响双氧水分解速率的因素。
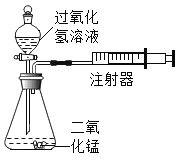
(1)实验小组有如下设计方案,完成下表。
实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 | 所需时间 |
实验I | 探究________ 对H2O2分解速率的影响 | 25℃ | 二氧化锰 | 10mL2%H2O2 | 60秒 |
实验II | 25℃ | 二氧化锰 | 10mL12%H2O2 | 30秒 |
由上表数据可知:双氧水的浓度越大,其分解速率________
(2)催化剂在生产、生活和科研中的地位越来越重要。实验室用过氧化氢溶液分解制取氧气时,就常用二氧化锰作催化剂。
[提出问题]氧化铜(CuO)能否起到类似MnO2的催化剂作用呢?
[猜想假设]猜想一: CuO不是该反应的催化剂。
猜想二: CuO参与反应产生O2,反应前后质量和化学性质发生了改变。
猜想三: CuO是反应的催化剂,反应前后_______
[实验探究]用天平称量0.2gCu0,取5mL5%的过氧化氢溶液于试管中,进行如下实验:

(注:氧化铜不落于水。过滤可与水分离)
[交流讨论]
(1)填写下表
步驟③现象 | 步驟⑤结果 | 结论 |
产生大量的气泡,带火星的木条发燃。 | 得到氧化铜的质量为__g | 猜想一、二不成立:猜想三成立。 |
(2)步骤④需用到的玻璃仪器有:玻璃棒、烧杯和________其中玻璃棒的作用________
【题目】某同学用锌和稀硫酸制取氢气.向气体发生装置中加入一定量锌粒,将15g稀硫酸分三次加入,每次生成气体的质量如下表。
次数 | 第一次 | 第二次 | 第三次 |
加入稀硫酸质量/g | 5 | 5 | 5 |
生成氢气质量/g | 0.02 | 0.02 | 0.01 |
请计算:
(1)共制得氢气_________g。
(2)所用稀硫酸的溶质质量分数为____________。